Зачем нужны белки в нашем питании и что происходит, если их не хватает?
Содержание:
Правила употребления белковой пищи
Начинайте день с белкового завтрака. Это обеспечит вам чувство сытости, и вы нескоро ещё проголодаетесь. Известный факт: в первой половине дня белки усваиваются лучше.
Сочетайте белковые продукты. Разбавьте рацион растительной белковой пищей.
Делите вашу порцию белков на протяжении дня. Организму сложно будет усвоить всю суточную норму белка за один раз.
Если вы ведёте активный образ жизни, порция белка через 30 минут после тренировки поможет прийти в идеальную форму.
Определите свою норму белка и строго придерживайтесь её. Количество белка выше нормы способно вызвать отравление.
Правильно сочетайте продукты. Например, водоросль спирулина неплохо совместима с овощами, которые богаты крахмалом. Отличным дополнением станут овощи и зелень. Бобовые идеально сочетаются с зеленью и кашами.
Готовьте белковые продукты при минимальной температуре, дольше их варите, а бобовые предварительно замачивайте.
Для переваривания белка нужно много воды. Употребляйте её достаточное количество: как правило, рекомендуется пить восемь стаканов воды в день.
Соблюдайте пропорцию белков в вашем рационе с жирами и углеводами, придерживайтесь вышеизложенных правил. Тогда вы почувствуете прилив сил и здоровья, а также уничтожите лишний вес. Удачи вам на пути к здоровой жизни!
https://youtube.com/watch?v=8RccgIHKg0Q
Любителям белковой диеты
Многие желающие похудеть часто прибегают к белковой диете и, надо признать, достигают неплохих результатов. Но вряд ли это можно назвать хорошей идеей. Потому что частое и длительное использование такой диеты непременно приведет к интоксикации, заболеваниям почек и печени, подагре и еще целому букету «приятностей», потому что лишний белок не усваивается, а поддается процессу гниения.
Продукты распада всасываются в кровь и отравляют организм. Напомню, что в древнем Китае одной из самых жестоких казней считалась «мясная диета», когда человека больше месяца кормили только мясом. Итог был мучительным и плачевным. А поэтому будем помнить о золотом чувстве меры и всемогущем сбалансированном питании.
Надеюсь, что мои страшилки не останутся без внимания. Удачи и до скорой встречи!
Избыток белка
Избыток белка также не рекомендуется, потому что азот, неиспользованный для создания белков организма, должен выводиться из организма. Аммиак образуется в печени из иона амина (содержащего азот) и диоксида углерода, который, в свою очередь, превращается в мочевину и выводится почками.
Таким образом, избыток потребленного белка по отношению к потребностям организма увеличивает количество выделяемых азотных соединений и, таким образом, создает дополнительную нагрузку на почки и печень. Избыток белка у младенцев может вызвать диарею, симптомы ацидоза, обезвоживание, гипераммонемию и лихорадку.
Кроме того, чрезмерное потребление белка обычно связано с увеличением потребления мяса, мясного ассорти и сыра с высоким содержанием жира. Такая диета с высоким содержанием белка может превратиться в диету с высоким содержанием жиров, что может привести к развитию ожирения и дислипидемии (липидных нарушений), за которыми следует атеросклероз и гипертония.
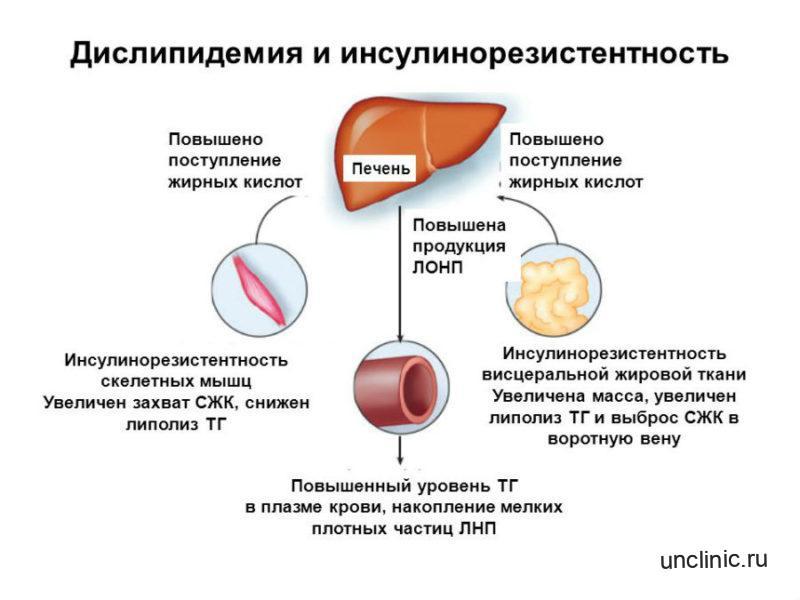
Дислипидемия
Более того, при большом количестве белка в пище может нарушиться метаболизм одной из аминокислот – метионина, особенно при недостаточном поступлении витаминов группы В (особенно витамина В 6). Это приводит к увеличению выработки гомоцистеина, одного из основных факторов риска атеросклероза.
Продолжительное употребление высокобелковой диеты приводит к увеличению выведения кальция с мочой. Если к тому же высокобелковая диета не сопровождается увеличением поступления кальция и витамина D с продуктами, увеличивается риск остеопороза.
Чрезмерное потребление белка может привести к развитию камней в почках и подагре, поэтому рекомендуется употреблять нужное количество белка и использовать диету с высоким содержанием белка только при заболеваниях (например, кахексии, хронических заболеваниях печени).
Аминокислоты
Белки состоят из аминокислотной цепи. Аминокислоты связываются между собой с образованием пептидных цепей, более 10 аминокислот — полипептиды.
Общая формула аминокислот H 2 N – CHR – COOH. Строение отдельных аминокислот кардинально отличается. Согласно им выделяют три основные группы аминокислот:
- алифатические;
- ароматические;
- гетероциклические.
Алифатические кислоты делятся на моноаминомонокарбоновые и моноаминодикарбоновые кислоты. В молекуле трех аминокислот — цистеина, цистина и метионина содержится атом серы.
Строение аминокислот
Аминокислоты — бесцветные кристаллические вещества. За исключением глицина, все они имеют асимметричный атом углерода и оптически активны. Человеческий белок содержит 20 отдельных аминокислот. Некоторые из них незаменимы (существенны), другие — заменяемы, потому что их можно синтезировать.
Во время катаболизма всех аминокислот образуются шесть веществ, которые участвуют в общем катаболическом процессе. Эти вещества представляют собой пируват, ацетил-КоА, кетоглутарат, сукцинил-КоА, фумарат и оксалоацетат.
Аминокислоты, из которых промежуточные продукты цикла Кребса (α-кетоглутарат, сукцинил-КоА, фумарат) образуются во время катаболизма и впоследствии превращаются в конечный продукт оксалоацетат и могут использоваться для гликогенеза, называются гликогенными аминокислотами.
Некоторые аминокислоты превращаются в ацетоацетат или ацетил-CoA во время катаболизма и могут использоваться для синтеза ацетоновых материалов. Их называют кетогенными. Многие аминокислоты используются в синтезе веществ глюкозы и ацетона, потому что катаболизм производит два продукта, соответствующий метаболит цикла Кребса и ацетоацетат (Tyr, Phe, Trp) или ацетил-КоА (Ile). Такие аминокислоты называют смешанными или гликокетогенными.
Почти все природные аминокислоты (за исключением метионина) реагируют с α-кетоглутаровой кислотой. Эта катализируемая трансаминазой реакция дает глутаминовую кислоту и соответствующую α-кетоновую кислоту. Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию под действием каталитической глутаматдегидрогеназы.
Действует как передатчик
Некоторые белки – это гормоны, которые являются химическими передатчиками, помогающими наладить связь между вашими клетками, тканями и органами.
Они производятся и секретируются эндокринными тканями или железами, а затем переносятся с кровотоком в их целевые ткани или органы, где они связываются с белковыми рецепторами на поверхности клетки.
Гормоны могут быть сгруппированы в три основные категории ():
- Белки и пептиды: они сделаны из цепей аминокислот, от нескольких до нескольких сотен.
- Стероиды: они образуются из холестерина. Половые гормоны, тестостерон и эстроген являются стероидами.
- Амины: они сделаны из отдельных аминокислот триптофана или тирозина, которые помогают производить гормоны, связанные со сном и метаболизмом.
Белок и полипептиды составляют большинство гормонов вашего организма.
Вот некоторые примеры этих гормонов ():
- Инсулин: способствует доставлению глюкозы или сахара в клетки.
- Глюкагон: сигнализирует о необходимости расщепления хранимой в печени глюкозы.
- Гормон роста (СТГ): стимулирует рост различных тканей, включая кость.
- Антидиуретический гормон (АДГ): сигнализирует почкам реабсорбировать воду.
- Адренокортикотропный гормон (АКТГ): стимулирует выделение кортизола, ключевого фактора метаболизма.
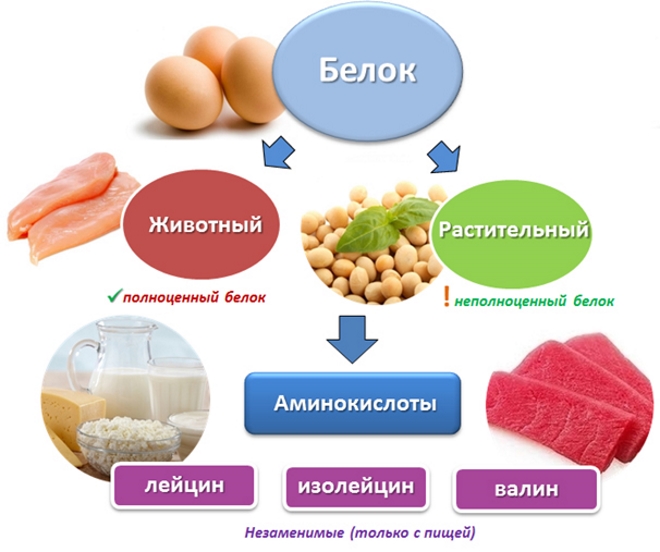
Растительный или животный?
До сих пор идут жаркие споры, какой белок более полезен нашему организму – животный или растительный? Непримиримые противники – вегетарианцы и любители мяса, похоже, никогда не достигнут консенсуса. А мы будем придерживаться академической точки зрения или золотой середины – все белки нужны и все они важны!
Где растет белок?
Некоторые растительные продукты тоже могут похвастаться высоким содержанием белка. Суперчемпионами в этой номинации являются:
- фасоль – 22-23 г;
- горох – 23-24 г;
- маш, чечевица – 24-25 г;
- соя – 34-35 г;
- семечки (подсолнечник) – 21-22 г;
- семечки (тыква) – 30-31 г;
- грецкий орех – 13,5 – 14 г;
- миндаль – 18-19 г;
Крупа гречневая и пшенная, овсянка и толокно содержат примерно по 12-13 г белка на 100 г продукта. А в какао порошке содержится до 26 г белков!
Функции белков
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Первые слова из определения Ф.Энгельсом понятия жизни «Жизнь есть способ существования белковых тел, …. » до сих пор, по прошествии полутора веков, не потеряли своей правильности и актуальности.
Структурная функция
Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности).
К данной функции можно отнести участие в создании органелл – рибосомы.
Ферментативная функция
Все ферменты являются белками. В то же время есть данные о существовании рибозимов, т.е. рибонуклеиновых кислот, обладающих каталитической активностью.
Гормональная функция
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (связывание кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют белки — Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.
Резервная функция
В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Сократительная функция
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Защитная функция
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови — например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны.
К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови.
Белковая буферная система участвует в поддержании кислотно-щелочного состояния.
Существуют белки, которые являются предметом особого изучения:
Монеллин – выделен из африканского растения, обладает очень сладким вкусом, не токсичен и не способствует ожирению.
Резилин – обладает почти идеальной эластичностью, составляет „шарниры» в местах прикрепления крыльев насекомых.
Белки со свойствами антифриза обнаружены у антарктических рыб, они предохраняют кровь от замерзания
Проблема белкового оптимума
Минимальное количество белков пищи, необходимое для восполнения разрушающихся белков организма, или величина распада белков организма при исключительно углеводном питании, обозначается как коэффициент изнашивания. У взрослого человека наименьшая величина этого коэффициента около 30 г белков в сутки. Однако этого количества недостаточно.
Жиры и углеводы оказывают влияние на расход белков сверх минимума, необходимого для пластических целей, так как они освобождают то количество энергии, которое требовалось для расщепления белков сверх минимума. Углеводы при нормальном питании уменьшают расщепление белков в 3-3,5 раза больше, чем при полном голодании.
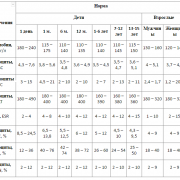
Для взрослого человека при смешанной пище, содержащей достаточное количество углеводов и жиров, и массе тела 70 кг норма белка в сутки равна 105 г.
Количество белка, полностью обеспечивающее рост и жизнедеятельность организма, обозначается как белковый оптимум и равно у человека при легкой работе 100-125 г белка в сутки, при тяжелой работе — до 165 г, а при очень тяжелой — 220-230 г.
Количество белка в сутки должно быть по массе не меньше 17% от общего количества пищи, а по энергии — 14%.
Функции белков.
Белки в клетке выполняют важные и многообразные функции. Прежде всего они выполняют строительную функцию
. Из белков состоят мембраны клеток и клеточных органоидов. У высших животных в основном из белков состоят стенки кровеносных сосудов, сухожилия, хрящи и т. д.
Громадное значение имеет каталитическая функция белков
. Из курса химии вам известно, что скорость химических реакций зависит от свойств реагирующих веществ, от их концентрации и температуры, при которой идет реакция. Химическая активность веществ в живой клетке, как правило, невелика. Концентрации их в клетке большей частью незначительны. Температура клеточной среды невысокая. Таким образом, реакции в клетке должны были бы протекать очень медленно. Между тем реакции в клетке идут с большими скоростями. Это достигается благодаря наличию в клетке катализаторов. Клеточные катализаторы называются ферментами. Каталитическая активность ферментов исключительно велика. Они ускоряют реакции в десятки, сотни миллионов раз. По химической структуре ферменты — белки. В большинстве случаев ферменты катализируют превращения веществ, размеры молекул которых по сравнению с размерами макромолекулы фермента очень малы. Например, фермент ката-лаза имеет молекулярную массу 250000, а пероксид водорода (Н 2 О 2), распад которого катализирует каталаза, всего 34. Такое соотношение между размерами фермента и веществом, на которое он действует, наводит на мысль, что каталитическая активность фермента определяется не всей его молекулой, а только небольшим ее участком — активным центром фермента. Как известно, реакция между веществами происходит при условии тесного сближения их молекул. Возможность сближения фермента и вещества происходит благодаря геометрическому соответствию структур активного центра фермента и молекулы вещества. Они подходят друг к другу, «как ключ к замку». При денатурации фермента его каталитическая активность исчезает, так как нарушается структура активного центра.
Почти каждая химическая реакция в клетке катализируется особым ферментом. Число различных реакций, протекающих в клетке, достигает нескольких тысяч. Соответственно в клетке обнаружено несколько тысяч разных ферментов.
Кроме строительной и каталитической функций, важна сигнальная функция белков
. В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
Белкам присуща также двигательная функция
. Движение — одно из проявлений жизненной активности. Все виды движения, к которым способны клетки у высших животных, в том числе и сокращение мышц, а также мерцание ресничек у простейших, движения жгутиков, выполняют особые сократительные белки.
Белки выполняют также транспортную функцию
. Они способны присоединять различные вещества и переносить их из одного места клетки в другое. Белок крови гемоглобин присоединяет кислород и разносит его ко всем тканям и органам тела.
Большое значение имеет защитная функция белков
. При введении чужеродных белков или клеток в организм в нем происходит выработка особых белков, которые связывают и обезвреживают чужеродные клетки и вещества.
Следует отметить, наконец, энергетическую функцию белков
. Белки распадаются в клетке до аминокислот. Часть аминокислот используется для синтеза белков, часть же подвергается глубокому расщеплению, в ходе которого освобождается энергия. При полном расщеплении 1 г белка освобождается 17,6 кДж.
О громадном значении белков для жизни догадывались давно. Сто лет назад Ф. Энгельс писал, что «жизнь есть форма существования белковых тел». Эта фраза стала крылатой, в ней подчеркивается решающее значение белков для жизни. Данные современной биологии полностью подтверждают этот вывод.
Образование белка из аминокислот
Белки формируются из своих составляющих из аминокислот. Белок формируется из 22 аминокислот, 14 из которых мы можем синтезировать сами, а 8 поступает только с пищей и называются они незаменимые.

Рис.1 Содержание белка в продуктах.
Точно также как мы сами не можем синтезировать йод, кальций, мы должны их получать. Если происходит исключение одной из аминокислот, ломается весь обменный процесс. Нарушается все белковое равновесие и обменные процессы начинают проходить по резервным путям с ограниченным использованием остального комплекса аминокислот. Под этот минимальный уровень, какого-то необходимого вещества выстраивается весь обмен веществ. Это касается и аминокислот и витаминов и микроэлементов. Если чего то не хватает это лимитирующая планка, когда организм выше прыгнуть не может.
Незаменимые аминокислоты участвуют не только в синтезе белков, каждая из них выполняет важную функцию. Если мы беремся решать какую то проблему в нашем организме, то у щитовидки, например, ни йодом единым решается проблема.
Коллаген
Коллаген — это основной белок соединительной ткани у животных. Коллаген содержится в костях, хрящах, сухожилиях, зубах, коже, роговице, легких, печени, кровеносных сосудах и других органах и тканях. На его долю приходится около 25-30% белка млекопитающих.
У человека и позвоночных было идентифицировано двенадцать типов коллагена, состоящего из более чем 24 различных полипептидных α-спиралей. Комбинации этих спиралей определяют типы коллагена. Например, наиболее распространенный коллаген I типа (90% общей массы коллагена) состоит из 2 спиралей α-1 и 1 α-2.
Структура коллагена
Коллаген отличается от других белков организма своим уникальным аминокислотным составом: 33%. из всех аминокислот составляют Gly, 10% – про, 10% – гидрокси-Pro и 1% – гидрокси-Lys. Основная структурная единица коллагена — тропоколаген, состоит из трех левовращающихся α-спиралей, скрученных в одну правовращающуюся суперспираль. Такие суперспирали связываются поперечными ковалентными связями с образованием фибрилл.
Основные функции
Принято выделять 11 функций белка:
- Транспортная.
- Строительная
- Регуляторная.
- Защитная.
- Двигательная.
- Сигнальная.
- Запасающая.
- Энергетическая.
- Каталитическая или ферментативная.
- Функция антифриза.
- Резервная или питательная.
Транспортная
Уникальная способность белков заключается в их умении присоединять различные вещества и транспортировать их к тем или иным тканям и органам:
- гемоглобин — белок в крови. Присоединяет к себе кислород и переносит его от легких ко всем органам и тканям, а от них забирает углекислый газ и перевозит обратно в легкие;
- липопротеины (от греческого lípos (Λίπος) — «жир», proteḯni (πρωτεΐνη) — «белок»). Отвечают за транспортировку жира;
- гаптоглобин. Связывает гемоглобин, попадающий в кровь при повреждении эритроцитов, и свободный гемоглобин, образуя комплекс гемоглобин-гаптоглобин. Он поглощается и утилизируется клетками печени. Печень возвращает организму аминокислоты глобина и железо гема;
- трансферрин. Вырабатывается в печени, связывает железо и переносит его по телу.
Белки выступают трансфером ионов кальция, магния, железа, меди и др.
Строительная
Белки участвуют в образовании клеточных и внеклеточных составов:
кератин. Основной компонент в составе волос, ногтей, перьев или копыт;
- коллаген. Главный элемент сухожилий и хрящей;
- эластин. Входит в состав связок;
- белки клеточных мембран. В основном это гликопротеины.
Регуляторная
Существует отдельная, довольно крупная группа белков, которая ориентируется на регулирование процессов обмена веществ. В этом принимают участие особые гормоны белковой природы. К примеру, инсулин, который контролирует уровень глюкозы в крови и способствует синтезу гликогена.
Защитная
Включается в случае проникновения в организм чужеродных белков или других микроорганизмов, антигенов. В ответ на нападение образуются специальные белки, антитела, которые выполняют функцию обезвреживания нежелательных веществ.
При кровотечении помогает фибрин, способствующий свертыванию крови.
Двигательная
Белки актин и миозин необходимы для сокращения мышц у многоклеточных организмов и других подвижных функций живых существ.
Сигнальная
На клетках есть мембраны, в которые встроены особые рецепторы. Это белки, которые могут изменять свою третичную структуру в зависимости от внешней среды. Так осуществляется передача команд из внешней среды в клетку.
Запасающая
В случаях длительного голодания организм животных или человека использует белки мышц, эпителиальных тканей и печени для поддержания жизнедеятельности организма.
Кроме того, белки участвуют в откладывании в качестве запаса некоторых веществ. Таким веществом может бы железо, которое не выводится из организма при распаде гемоглобина, а образует комплекс с белком ферритином.
Энергетическая
В качестве источника энергии белки — очень дорогостоящий продукт для нашего тела. Он используется в последнюю очередь, когда израсходованы все углеводы и жиры. При распаде 1 грамма белка выделяется 17,6 кДж энергии. Первым делом они распадаются до аминокислот, а потом до конечных продуктов: воды, углекислого газа и аммиака.
Каталитическая (ферментативная)
Одна из самых важных для организма функций осуществляется за счет особых белков, ферментов (биохимических катализаторов). Они ускоряют биохимические реакции в клетках.
Ферменты можно разделить на:
- Простые. Состоят исключительно из аминокислот.
- Сложные. Помимо белковой части в их состав входит группа небелкового происхождения (кофактор). У некоторых ферментов эту роль играют витамины.
Функция антифриза
У некоторых существ в плазме крови есть белки, которые предупреждают ее замерзание. Такая способность белка является необходимой для выживания в условиях экстремально низких температур.
Питательная (резервная)
Ее выполняют резервные белки, которые становятся для плода источниками питания. В качестве примера можно привести белки яйца (овальбумины) или основной белок молока (казеин).
Итоги
О том, какова роль белков в организме, написано десятки статей и диссертаций. Все это подкрепляется тем, что мы видим в реальности. Сбалансированный рацион – путь к здоровью. Главное – обеспечить поступление аминокислот в достаточном объеме.
Подробное описание всех этапов диеты Дюкана
В какое время прием углеводно-белковых смесей будет оптимальным
Как помочь младенцу когда режутся первые зубы?
Пошаговые рецепты приготовления торта Прага с фото
Винпоцетин или Циннаризин – как не ошибиться в выборе
Лечение молочницы Мирамистином
Гейнер Mutant Mass: состав, преимущества и схема приема
Клотримазол от лишая для взрослых и детей: применение, эффективность и отзывы
11 февраля, 2019 —