Пауэрлифтинг в смоленской области
Содержание:
- Рецепторы ИФР
- Смешанный (гибридный) тип рецепторов и инсулин-связанный рецептор (IRR)
- Болезни, на которые влияет IGF
- Может ли дефицит ИФР-1 принимать участие в развитии метаболического синдрома?
- Норма для взрослых и детей
- Как определяется уровень ИФР
- Гормоны, относящиеся к системе ИФР. Структура белков ИФР1 и ИФР2
- Дозировки и схемы применения
- Комбинация ИФР-1 с другими препаратами для сушки
- Инсулиноподобный фактор роста-1 и метаболизм углеводов
- История создания
- Особенности сдачи анализов
Рецепторы ИФР
Обе разновидности ИФР вступают во взаимодействие с большим количеством мембранных рецепторов, представленных на клетках-мишенях в изолированном виде либо в комбинации. Изначально, предполагалось, что ИФР-1 стимулирует свой же рецептор – тирозинкиназу, функционально и структурно схожую с инсулиновыми рецепторами. При этом установлено, что ИФР-2 имеет большую степень аффинности со своим рецептором, в отличие от ИФР-1. Последующие эксперименты выявили, что обе разновидности гормона вступают во взаимодействие с рецепторами ИФР-1, при том, что степень аффинности ИФР-1 к данному типу рецепторов в 3 раза больше в сравнении с ИФР-2. При клонировании ДНК рецептора ИФР-2 было установлено, что он имеет много схожего с описанным ранее рецептором маннозо-6-фосфата, участвующем в эндоцитозе и транспортировке маннозо-фосфатных белков. При этом, в ранних исследованиях утверждались сведения о значимости рецептора ИФР-1 в транспортировке сигнала ИФР-2, полученные на основании однородной структуры компонента рецептора ИФР-2 и петли рецепторов G-белков, находящихся внутри клетки. Дальнейшие эксперименты полностью исключали вероятность сигнальной передачи через небольшой компонент рецептора ИФР-2 внутри цитоплазмы. Утверждается, что функция данной молекулы в системе воздействия факторов роста демонстрирует её способность к клиренсу рецепторов ИФР-2 и, соответственно, оказывает воздействие на уровень ИФР-2 во внешнем пространстве (вне клеток).
Действие ИФР-1 объясняется как правило стимуляцией рецепторов ИФР-1; сам гормон не обладает способностью к перекрёстному воздействию с инсулиновыми рецепторами (исключение составляет фармакологическое воздействие), так как относительная степень аффинности ИФР-1 к своим рецепторам, по меньшей мере, в 2 раза выше чем к инсулиновым рецепторам. Изначально утверждалось, что ИФР-2, также, как и ИФР-1, вступает в связь, в основном, с рецепторами ИФР-1, а не с инсулиновыми. Эксперименты на грызунах с мутацией и нехваткой составляющих сигнальной системы инсулиновых и ИФР-рецепторов выявили, что ИФР-2 в начале своего развития функционирует с помощью инсулиновых рецепторов ещё до идентифицируемой экспрессии ИФР-рецепторов. Молекулярные положения данного процесса были открыты после определения вариативности инсулиновых рецепторов, формирующихся в ходе альтернативного синтеза с высокой степенью аффинности к ИФР-Н. А именно, транскрипт инсулинового рецептора синтезируется наряду с 11-ым экзоном, кодирующим фрагмент из 12 остатков аминокислот на С-конце мембранной бета-субъединицы, расположенной с внешней стороны клетки. Ранние эксперименты доказали, что форма инсулинового рецептора, кодируемая матричной РНК без 11-ого экзона (формы «А»), имеет высокую степень аффинности к инсулину, в отличие от формы «В» с наличием 11-ого экзона. Выявлено, то форма «А» достоверно является рецептором ИФР-2 с высокой степенью аффинности и стимулирует в основном процессы пролиферации, а не метаболические процессы, индуцированные стимуляцией инсулиновых рецепторов формы «В». Следовательно, ИФР-1 действует преимущественно за счёт стимуляции ИФР-1-рецепторов, при том, что ИФР-2 оказывает своё влияние путём стимуляции ИФР-1-рецепторов или инсулиновых рецепторов изоформы «А».
Смешанный (гибридный) тип рецепторов и инсулин-связанный рецептор (IRR)
Система сигнальной передачи ИФР существенно затрудняется за счёт наличия гибридных рецепторов, образованных в процессе димеризации ИФР-1-рецепторов и инсулиновых рецепторов. Каждых из них включает в свой состав отдельные альфа-субъединицы и бета-субъединицы, объединённые ковалентной связью между 2-мя атомами серы (дисульфидная связь). Подобные гибридные рецепторы формируются в процессе создания ковалентной связи между 2-мя альфа-субъединицами в комплексе Гольджи в клетках, которые экспрессируют параллельно и ИФР-рецепторы, и инсулиновые рецепторы. Однако изначально предполагали, что гибриды представляют небольшую часть ИФР- и инсулиновых рецепторов. По некоторым сведениям, полученным в ходе исследований, выявлено, что количество гибридных рецепторов может превышать число гетеротеграмеров рецепторов ИФР и инсулина. Это вероятно может объясняться преимущественным формированием дисульфидных связей у цистеиновых остатков альфа-субъединиц рецепторов ИФР и инсулина. Следовательно, в некоторых случаях на оболочке клеток гибридных рецепторов может оказаться большое число обычных рецепторов.
Касательно образования связей, у гибридных рецепторов ИФР\инсулина имеется высокая степень аффинности к ИФР-1, однако аффинность к инсулину на порядок меньше, в отличие от обычных рецепторов инсулина.
Утверждается, что это можно объяснить возможностью ИФР-1 благополучно образовывать связи с альфа-субъединицей, при том, что инсулину для образования связи следует взаимодействовать с 2-мя бета-субъединицами инсулинового рецептора. Из-за этого присутствие на клеточной оболочке большого числа гибридных рецепторов возможно приведёт к селективному снижению чувствительности клеток именно к инсулину, а не к инсулиноподобному фактору роста. Специалисты предположили, что благодаря этому механизму происходит ускорение экспрессии ИФР-рецепторов, а это в свою очередь приводит к инсулинорезистентности клеток, в которых происходит экспрессия генов инсулиновых рецепторов. Положение гибридных рецепторов осложняется также наличием различных по степени аффинности к ИФР-Н изоформ рецепторов инсулина «А» и «В». Формирование гибридных инсулиновых рецепторов «А» и «В», по всей видимости, вполне вероятно, так как большинстве клеток наблюдается экспрессия двух вариаций синтеза. Трудности, обусловленные различием обеих вариаций, мешают в проведении анализа степени связывания и сигнальной передачи данным классом рецепторов. Наряду с эти было выявлено, что гибридные рецепторы ИФР-1 и рецепторы инсулина «А» вступают во взаимосвязь с ИФР-1\ИФР-Н и инсулином, а рецепторы ИФР-1 и инсулиновые рецепторы «В» с высокой степенью аффинности связываются с низкоаффинными ИФР-1 и ИФР-Н, однако, при этом не связываются с инсулином. Следовательно, относительная степень экспрессии ИФР-1-рецепторов и инсулиновых рецепторов, а также возможность вариаций альтернативного синтеза у 11-ого экзона измеряет способность каждой отдельно взятой клетки на реакцию с ИФР-Н, ИФР-1 и с инсулином.
Третьим компонентом инсулиновых рецепторов и ИФР являются инсулин-связанные рецепторы (IRR), не обладающие аффинностью к ИФР и инсулину. Вопреки тому, что ещё не найден белок, являющийся специфическим гормоном для этого типа рецепторов, установлено, что IRR способствует формированию гибридных рецепторов с рецепторами инсулина в результате усиления экспрессии обоих типов белка в фибробластах. Следовательно, существует вероятность формирования гибридных рецепторов ИФР-рецептор-инсулиновый рецептор\IRR, инсулиновый рецептор-А\IRR либо инсулиновый рецептор В\IRR в клетках, где отмечается экспрессия гена IRR, а также вероятность того, что формирование подобных рецепторов, как и формирование гибридов ИФР-рецептор\IRR, способно оказывать воздействие на чувствительность клеток к инсулину и ИФР. Недавние эксперименты на крысах с изменённой (мутированной) ДНК и удалёнными генами инсулиновых рецепторов, ИФР-рецепторов и инсулин-связанных рецепторов (IRR) определили значение последних в развитии половых органов, вероятно обусловленном стимуляцией функциональности рецепторов инсулина и ИФР-рецепторов путём формирования гибридов.
Болезни, на которые влияет IGF
Исследования последних лет показывают, что ось инсулин / IGF играет важную роль в старении. Нематоды, плодовые мухи и другие организмы имеют увеличенную продолжительность жизни, когда ген, эквивалентный инсулину у млекопитающих, нокаутирован. Тем не менее, довольно трудно связать это открытие с млекопитающими, потому что в меньшем организме есть много генов (по крайней мере, 37 у нематоды Caenorhabditis elegans), которые являются «инсулиноподобными» или «IGF-1-подобными», тогда как у млекопитающих инсулиноподобные белки включают только семь членов (инсулин, IGFs, релаксины, EPIL и релаксиноподобный фактор). Человеческие инсулиноподобные гены, по-видимому, играют разные роли, но меньше пересекаются, по-видимому, из-за того, что у человека имеется множество белков, подобных рецептору инсулина. У более простых организмов обычно меньше рецепторов; например, в нематоде C. elegans существует только один инсулиноподобный рецептор. Кроме того, C. elegans не имеет специализированных органов, таких как островки Лангерганса, которые чувствуют инсулин в ответ на гомеостаз глюкозы. Кроме того, IGF1 влияет на продолжительность жизни нематод, вызывая образование дауэра, стадии развития личинки C. elegans. Корреляты у млекопитающих отсутствуют. Следовательно, остается открытым вопрос относительно того, может ли IGF-1 или инсулин у млекопитающего нарушать старение, хотя существует предположение, что с этим могут быть связаны диетические ограничения.
Другие исследования начинают раскрывать важную роль IGFs при таких заболеваниях, как рак и диабет, показывая, например, что IGF-1 стимулирует рост клеток как простаты, так и рака молочной железы. Исследователи не полностью согласны со степенью риска развития рака, который представляет собой IGF-1.
Список использованной литературы:
Gunnell D, Miller LL, Rogers I, Holly JM (November 2005). «Association of Insulin-like Growth Factor I and Insulin-like Growth Factor-Binding Protein-3 with Intelligence Quotient Among 8- to 9-Year-Old Children in the Avon Longitudinal Study of Parents and Children». Pediatrics. 116 (5): e681–6. doi:10.1542/peds.2004-2390. PMID 16263982.
Bornfeldt KE, Arnqvist HJ, Dahlkvist HH, Skottner A, Wikberg JE (April 1988). «Receptors for insulin-like growth factor-I in plasma membranes isolated from bovine mesenteric arteries». Acta Endocrinol. 117 (4): 428–34. PMID 2968745.
Kenyon CJ (March 2010). «The genetics of ageing». Nature. 464 (7288): 504–12. doi:10.1038/nature08980. PMID 20336132.
Rowlands MA, Holly JM, Gunnell D, Donovan J, Lane JA, Hamdy F, Neal DE, Oliver S, Smith GD, Martin RM (January 2012). «Circulating insulin-like growth factors and IGF-binding proteins in PSA-detected prostate cancer: the large case-control study ProtecT». Cancer Research. 72 (2): 503–15. doi:10.1158/0008-5472.CAN-11-1601. PMC 3272440. PMID 22106399.
Может ли дефицит ИФР-1 принимать участие в развитии метаболического синдрома?
- Факторы риска метаболического синдрома:
- нарушение метаболизма липидов,
- нарушение метаболизма углеводов,
- инсулинорезистентность,
- висцеральное ожирение.
- Сходство ИФР-1 и инсулина даёт возможность предположить участие ИФР-1 в метаболическом синдроме.
- Считается, что прогноз у пациентов с метаболическим синдромом и низким уровнем ИФР-1 хуже, чем при нормальных или высоких показателях ИФР-1.
- Низкий уровень ИФР-1 ассоциирован с инсулинорезистентностью и СД 2 типа.
- Было показано, что соотношение ИФР-1/ИФР-1-связывающий белок положительно коррелирует с метаболическим синдромом и его компонентами.
- Масса висцеральной жировой ткани обратно пропорционально коррелирует с уровнем свободного ИФР-1, однако механизм этого пока неизвестен.
- ИФР-1 влияет на метаболизм липидов и углеводов.
- Стоит сказать, что полная элиминация ИФР-1 у мышей не приводила к инсулинорезистентности, однако такие животные не жизнеспособны и результаты нельзя назвать достоверными.
- При частичном удалении ИФР-1 развивается компенсаторное увеличение в три раза концентрации гормона роста.
- Совместно эти изменения приводят к инсулинорезистентности.
- При экзогенном введении ИФР-1 улучшение чувствительности к инсулину происходит благодаря снижению концентрации гормона роста.
- Концентрация ИФР-1 положительно коррелирует с уровнем адипонектина.
- Так как основным органом, продуцирующим ИФР-1, является печень, при её заболеваниях снижается уровень ИФР-1 и коррелирует со стадиями инсулинорезистентности и метаболического синдрома.
- Уровень ИФР-1 у людей при СД 2 типа крайне вариабелен. Это зависит от:
- повышенного уровня цитокинов,
- снижения чувствительности к инсулину в печени,
- изменений ИФР-1-связывающих белков,
- эффектов ожирения,
- генетических факторов и влияния окружающей среды.
- Исследования на трансгенных мышах с инактивированным рецептором к ИФР-1 и гибридным инсулиновым рецептором показали развитие диабета в раннем возрасте.
- Igf1r+/- мыши показали снижение постнатального роста и инсулинорезистентность
- Новорождённые мыши с дефицитом ИФР-1 рождались с меньшей массой, чем контрольная группа.
- При ожирении происходит:
- продукция цитокинов и активных форм кислорода (ROS),
- апоптоз,
- митохондриальные и белковые нарушения,
- снижение содержания АТФ.
- Все это сопровождается:
- нарушением фосфорилирования ИРС,
- снижением экспрессии митохондриальных белков коактиваторовPPARy1α и белков отщепления-2 (USP-2).
- У людей с синдромом Ларона (врождённый дефицик ИФР-1 или толерантность к гормону роста) без специфического лечения в скором времени развивается метаболический синдром и СД 2 типа.
Норма для взрослых и детей

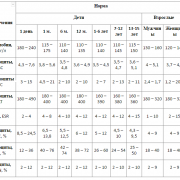
Оптимальные показатели соматомедина (измерение в мг/л):
- возраст от 0 до 2 лет: девочки – от 11 до 206, мальчики – от 31 до 160;
- возраст от 2 до 15 лет: девочки – от 286 до 660, мальчики – от 165 до 616.
Подростковый и юношеский период:
- девушки – от 398 до 709;
- юноши – от 472 до 706.
Взрослые женщины и мужчины:
- с 20 до 30 лет – от 232 до 385;
- с 40 до 50 лет – от 140 до 310;
- после 60 лет – от 94 до 269.
Уровень соматомедина изменяется в течение жизни, у лиц женского и мужского пола показатели ИФР – 1 различны. Допустимые значения несколько отличаются в различных лабораториях. При оценке результатов анализа врач учитывает пол и возраст пациента. Концентрация соматомедина стабильна на протяжении дня, в отличие от соматотропина, уровень которого повышается в ночное время.
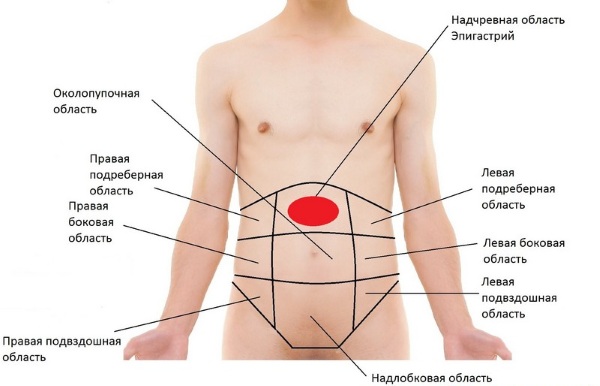
Как определяется уровень ИФР
Определение концентрации белка, выделяемого печенью, требуется для того, чтобы оценить нарушения функции гипофиза. А учитывая, что выработка гормона роста происходит очень разрозненно и может сильно колебаться, его оценивают на основании анализа, показывающего концентрацию в крови ИФР, так как он в течение дня остается практически неизменным. Вне зависимости от того, повышен он или понижен, результаты окажутся достоверными.
Особенности проведения анализа
Для получения достоверных результатов, сдавать анализ крови на выработку ИФР необходимо при соблюдении определенных правил.
- Анализ берется утром в период с 7 до 10 часов (в противном случае показатель может быть несколько повышен).
- За 8-12 часов до начала теста нельзя употреблять никакой пищи, кроме чистой воды.
- Исказить результаты анализа могут курение и алкоголь. Поэтому от них следует также отказаться.
- На результаты анализа могут оказывать влияние медицинские препараты. Поэтому следует отказаться от их приема. Исключение составляют лишь жизненно важные медикаменты.
- За сутки до теста следует воздержаться от занятий спортом и любой физической нагрузки.
- Полчаса до начала анализа следует провести в полном покое.
Проведение анализа на выработку ИФР
На показатели уровня ИФР оказывают влияние возраст и половая принадлежность сдающего кровь.
Анализ берется в нескольких случаях:
- при заболеваниях, вызванных недостаточной или избыточной выработкой гормона роста;
- при гигантизме или карликовости у детей;
- при акромегалии или невыясненной причине изменения внешности;
- если костный возраст, определяемый на основе рентгенографии кистей, не соответствует паспортному;
- при имеющихся нарушениях деятельности гипофиза;
- для оценки проведения лечения синтетическим гормоном роста.
Гормоны, относящиеся к системе ИФР. Структура белков ИФР1 и ИФР2
Оба вида белков несут в себе наследственную информацию о крупных генах, которые полностью и достоверно описаны у человека. Созревший ИФР1 состоит из элементов А и В, гомологичных по отношению к инсулиновой пептидной цепи. Отличием от инсулиновых компонентов является то, что элементы А и В ИФР-1 претерпевают белковое расщепление и остаются в связанном виде в созревшем белке на С-конце, соответствующим инсулиновому С-пептиду. В структуре ИФР1 и ИФР2 также имеется дополнительный элемент D, отсутствующий у инсулина. Помимо этого, ИФР имеют Е-пептид с «концом С», отсоединяющийся от комплекса Гольджи в ходе синтеза. Дополнительная взаимосвязь 5-ого и 6-ого экзонов человеческого и крысиного ИФР-1 способствует формированию совершенно новых Е-пептидов, при этом основная функция гормона с такой структурой не ясна. Присутствие лидерной последовательности пептидных экзонов в ДНК ИФР1 у многих животных способствует образованию полиморфизма у пептидных прекурсоров прогормонов, участвующих в передачи сигналов, однако также её физиологическая роль не определена. Формирование и структуризация человеческого ДНК ИФР-2 представляют из себя ряд сложных процессов, при этом экзоны, находящиеся в структуре ДНК не имеют кодирующих соединений и, следовательно, не оказывают влияния на строение созревшей молекулы ИФР-2 либо на её прекурсоры.
Дозировки и схемы применения
Первое, что нужно сказать, это о рабочей дозе Фактора. Эксперименты в этой области начались довольно давно. В принципе, сразу же, как только про данное лекарство пронюхали атлеты профи от культуризма. Так вот, большинство специалистов, сходятся во мнении, что диапазон оптимальных дозировок лежит в районе 80 – 120 МКГ в сутки. Меньше не о чём. Больше чревато побочными эффектами. Пожалуй, наиболее разумно будет, остановится на дозе в 100 МКГ в сутки. Тем более, что один флакон препарата, как правило, содержит именно столько.
Суточная доза делится на три раза, и вводится с утра после пробуждения (самая объёмная), за час до тренировки и через час после неё. Препарат ставится исключительно системно (жировая складка на животе). Ставить Фактор локально не имеет смысла (для этого существует одна из его разновидностей — Механический фактор роста (МФР)).
С учётом крайне быстрой даунрегуляции (угнетения) рецепторов этого вещества в организме, ставят его только в дни тренировок (3-4 раза в неделю). Продолжительность курса максимум 4 недели. Перерыв по продолжительности аналогичен курсу. При ежедневном использовании, выраженное уменьшение количества рецепторов происходит уже через 8 – 10 дней.
Протокол приёма Фактора неизменен в не зависимости от целей курса. В виде порошка, препарат остаётся стабильным на протяжении трёх лет, при хранении в условиях от – 20-ти до +37-ми градусах. Приготовленный раствор хранится не более суток при температуре, не превышающей +8 градусов.
Перед тем, как расскажу о комбинировании Фактора с другими препаратами, хочу выделить важный момент. ИФР–1, это исключительно спорадическое средство, если речь идёт о наборе мышечной массы или сжигании жира. То есть, он может оказаться отличным помощником, в качестве дополнения к курсу. Использовать его в одиночку, для роста или сушки СОВЕРШЕННО БЕСПОЛЕЗНО И НЕОПРАВДАНО.
Комбинация ИФР-1 с другими препаратами для сушки
По поводу ОБЯЗАТЕЛЬНОГО присутствия Тестостерона и АС (по желанию), думаю, все уже и так поняли. Идеальным напарником для Фактора в этот период станет именно Гормон Роста. Сам по себе, Фактор жиросжигателем не является. Но, способен невероятно сильно повышать активность ГР. Плюс, он отлично защищает мясо в период полуголодного состояния и интенсивных нагрузок. Комбинация ГР и Фактора, на фоне низкоуглеводной диеты является супер эффективной. Ходят слухи, что большинство топ профи сидят на ней в перерывах между турнирами, для сохранения наилучшей формы.
Это уже из личного опыта. Не секрет, что многие любители используют гормоны щитовидной железы, в период сушки. Дёшево и сердито. Одна беда — вместе с салом Трийодтиронин/Тироксин отлично разрушают и мышечную ткань. Сочетание Тестостерона/Т3 или Т4/ИФР – 1, позволит вам не только уверенно избавиться от ненавистного жира, но и поможет пройти этот тернистый путь, практически, без мышечных потерь.
Инсулиноподобный фактор роста-1 и метаболизм углеводов
- ИФР-1 повышает захват глюкозы в периферических тканях.
- Экзогенный ИФР-1 снижает уровень глюкозы в плазме крови и у здоровых людей, и у пациентов с СД 1 и 2 типа, а также в общем у людей, резистентных к инсулину
- В исследованиях показано, что при резистентности к инулину повышается количество гибридных рецепторов к инсулину/ИФР-1 в мышечной и жировой тканях
- Высокие дозы ИФР-1 обычно приводят к гипогликемии,
- Несмотря на снижение концентрации циркулирующего в крови инсулина.
- В группе мышей с инактивированными генами рецептора инсулина было показано снижение глюкозы в крови при помощи ИФР-1.
- Что свидетельствует о том, что ИФР-1 действует не только через гибридные рецепторы инсулина на метаболизм углеводов, но и через свои специфические рецепторы.
- Позже было пересмотрено действие ИФР-1 на мышцы и установлено прямое влияние на поглощение глюкозы.
- У мышей с инактивированными генами ИФР-1 в печени развивалась резистентность к инсулину.
- В этих условиях происходило повышение концентрации глюкозы и существенное снижение инсулин-индуцированного аутофосфорилирования рецептора к инсулину и ИРС в скелетных мышцах
- После экзогенного введения ИФР-1 всё восстановилось.
- Можно сделать вывод, что печёночная экспрессия ИФР-1 играет ключевую роль в сигнальном каскаде инсулина в скелетных мышцах и поглощении ими глюкозы
- У мышей с инактивированными генами ИФР-1 в печени развивалась резистентность к инсулину.
- При отсутствии гибридных рецепторов и инактивации рецепторов к ИФР-1 в мышцах возникала резистентность к инсулину и СД 2 типа в раннем возрасте.
- Также, вероятно ИФР-1 влияет на глюконеогенез в почках.
- Кроме того, экспрессия рецепторов ИФР-1 была обнаружена и в печени,
- ИФР-1 снижает уровень гормона роста в плазме крови благодаря отрицательной обратной связи.
- Это ведёт к снижению влияния гормона роста на функции печени, в том числе улучшая чувствительность к инсулину.
- Как и в жировой ткани, так и в печени гормон роста инициирует синтез субъединицыPI3K -p85,
- что ведёт к суппрессии активности p110
- Таким образом, ИФР-1 может косвенно влиять на метаболизм углеводов через
- снижение концентрации гормона роста в плазме крови,
- повышение активности инсулина.
- В постпрандиальный период уровень ИФР-1 в крови увеличивается.
- Свободный ИФР-1 способствует:
- окислению жирный кислот в мышцах,
- подавлению гормона роста,
- стимуляции транспорта глюкозы в мышечную ткань,
- подавлению глюконеогенеза в почках.
- ИФР-1-связывающие белки также играю роль в метаболизме углеводов с помощью влияния на ИФР-1.
- ИФР-1-связывающие белки взаимодействуют с ядерным рецептором RXR-α.
- Тот, в свою очередь, реагирует с PPAR-γ,
- ИФР-1-связывающие белки взаимодействуют с ядерным рецептором RXR-α.
- Повышенная экспрессия ИФР-1-связывающих белков ассоциирована с резистентностью к инсулину.
- В исследовании на мышах с неполной секрецией ИФР-1 было показано снижение экспрессии генов, участвующих в метаболизме глюкозы:
- фосфоенолпируваткарбоксилазы-1,
- глюкозо-6-фосфатазы,
- пируватдегидрогеназыкиназы изофермента-4,
- АТФ-цитратлиазы.
- Что приводило к гипергликемии.
- Эти изменения были купированы заместительной терапией низкими дозами ИФР-1 в течении 10 дней.
- Известно, что инсулин повышает экспрессию данных генов.
- Результаты исследования показывают противоположные инсулину эффекты дефицита ИФР-1.
- Свойства ИФР-1 в данном случае не “инсулиноподобны”, а антагонистичны.
- Кроме того, пируватдегидрогеназыкиназы изофермент-4 кодирует пируватдегидрогеназныйкомплекс (ПДК).
- ПДК является новой мишенью при лечении метаболического синдрома с помощью поддержания стабильного содержания АТФ в клетке.
- Это происходит благодаря эффективному использования свободных жирных кислот и глюкозы с помощью ПДК.
- В исследовании на мышах с неполной секрецией ИФР-1 было показано снижение экспрессии генов, участвующих в метаболизме глюкозы:
История создания
Управление
по санитарному надзору за качеством пищевых продуктов и медикаментов США
одобрило использование ИФР-1 в качестве медикамента в 2005 году. В Соединённых
Штатах данный продукт производится компанией Tercica в Калифорнии под торговым
названием Increlex. Технология производства ИФР, была приобретена компанией Tercica
у Genentech (пионера в продаже синтетического ГР в Соедиённых Штатах). Осенью
2006 года компания Tercica
лицензировала свою деятельность по популяризации производимого ею ИФР в Европе
(для компании Ипсен), в дальнейшем (уже летом 2007 года) компания Ипсен получила
разрешение на маркетинговое продвижение Increlex в Евросоюзе.
Особенности сдачи анализов
В течение дня уровень гормона не колеблется. Именно поэтому этот анализ при необходимости используют для определения уровня соматотропина, концентрация которого непостоянна, колеблется на протяжении суток.
Чтобы определить концентрацию инсулинового фактора роста используется анализ иммунохемилюминесцентный. Он заключается в определении связывания молекул с антителами.
Метод предусматривает сдачу крови из вены пациента. Принимать пищу до сдачи анализа нельзя как минимум 8–10 часов. Прием препаратов недопустим, исключения являются только случаи, угрожающие жизни больного. Пить можно только минеральную негазированную воду. Человек должен быть абсолютно здоров, никаких простудных заболеваний. Иначе результаты могут быть искаженными.
Во время сдачи специалист обязательно на бланке указывает возраст больного, так как описано выше, норма ИФР индивидуальна для каждого периода возраста.
Не стоит самостоятельно пытаться расшифровать анализы. Исходя из общей картины, собранного анамнеза, результатов лабораторного анализа специалист поставить диагноз, назначит соответствующее лечение.