Вход в личный кабинет
Содержание:
IFN1 против SARS-CoV2
Знания, полученные в ходе исследований по применению IFN-I для лечения SARS-CoV и MERS-CoV, используются при выборе потенциальных методов лечения SARS-CoV-2.
SARS-CoV и MERS-CoV способны нарушать сигнальный путь интерферона.
SARS-CoV2 существенно более чувствителен к IFN-I, чем SARS-CoV. Поэтому лечение SARS-CoV2 интерфероном I типа может быть по крайней мере столь же эффективным. В поддержку этой гипотезы было показано, что спреи IFNα2b могут снизить уровень заболеваемости SARS-CoV-2. Это исследование демонстрирует, что IFN-I может быть использован для профилактики SARS-CoV-2, в то время как репликация MERS-CoV и SARS-CoV, индифферентна к профилактике интерфероном.
Интерферон, инструкция по применению
Инструкция по применению интерферонов альфа, бета и гамма указывает, что перед тем, как назначить пациенту препарат, рекомендуется определить, насколько чувствительна к нему микрофлора, ставшая причиной заболевания.
Способ введения интерферона лейкоцитарного человеческого определяется в зависимости от поставленного пациенту диагноза. В большинстве случаев его назначают в виде подкожных инъекций, но в ряде случаев препарат допускается вводить в мышцу или вену.
Дозу для лечения, поддерживающую дозу и продолжительность лечения определяют в зависимости от клинической ситуации и ответа организма пациента на назначенную ему терапию.
“Детский” интерферон — это свечи, капли и мазь.
Инструкция по применению интерферона для детей рекомендует использовать этот препарат как лечебное, так и как профилактическое средство. Дозу для грудничков и детей более старшего возраста подбирает лечащий врач.
В профилактических целях INF применяют в виде раствора, для приготовления которого используют дистиллированную или кипяченую воду комнатной температуры. Готовый раствор окрашен в красный цвет и опалесцирует. Хранить его следует в холоде не более 24-48 часов. Препарат закапывают в нос детям и взрослым.
При вирусных офтальмологических заболеваниях препарат назначают в форме капель для глаз.
Рекомендованная доза для закапывания в конъюнктивальную полость пораженного инфекцией глаза — 2 капли (капают их через каждые два часа). Кратность закапываний — не менее 6 в сутки.
Как только выраженность симптомов заболевания уменьшается, объем инстилляций следует уменьшить до одной капли. Курс лечения — от 7 до 10 дней.
Для лечения поражений, вызванных герпесвирусами, мазь тонким слоем наносят на пораженные участки кожи и слизистых два раза в сутки, выдерживая 12-тичасовые интервалы. Курс лечения — от 3 до 5 дней (пока полностью не восстановится целостность нарушенного кожного покрова и слизистых).
Для профилактики ОРЗ и гриппа необходимо смазывать мазью носовые ходы. Кратность процедур в течение 1-й и 3-й недели курса — 2 раза в сутки. В период 2-й недели рекомендуется сделать перерыв. В профилактических целях интерферон следует использовать в течение всего периода эпидемии респираторных заболеваний.
Свечи интерферон вводят ректально. Рекомендованная инструкцией доза — 1 суппозиторий 1 или 2 раза в сутки. Курс лечения — от 5 до 10 дней.
Длительность реабилитационного курса у детей, у которых часто возникают рецидивирующие вирусно-бактериальные инфекции респираторного тракта, ЛОР-органов, рецидивирующая инфекция, вызванная вирусом простого герпеса, составляет два месяца.
Таблетки интерферона рекомендуется принимать в дозе, равной 2050 МЕ на каждый килограмм веса пациента (но не более 1000000 МЕ).
Как разводить и как применять интерферон в ампулах?
Инструкция по применению интерферона в ампулах указывает, что перед употреблением ампулу необходимо вскрыть, влить в нее воду (дистиллированную или кипяченую) комнатной температуры до отметки на ампуле, соответствующей 2-м мл.
Содержимое осторожно встряхивают до полного растворения. Раствор вводят в каждый носовой ход дважды в сутки по пять капель, выдерживая между введениями интервалы не менее шести часов. В лечебных целях IFN начинают принимать при появлении первых симптомов гриппа
Эффективность препарата тем выше, чем раньше пациент начнет его прием
В лечебных целях IFN начинают принимать при появлении первых симптомов гриппа. Эффективность препарата тем выше, чем раньше пациент начнет его прием.
Наиболее эффективным считается ингаляционный способ (через нос или рот). Для одной ингаляции рекомендуется брать содержимое трех ампул препарата, растворенное в 10-ти мл воды.
Воду предварительно подогревают до температуры не более +37 °С. Процедуры ингаляции проводят дважды в сутки, выдерживая между ними интервал не менее одного-двух часов.
При распылении или закапывании содержимое ампулы растворяют в двух миллилитрах воды и вводят по 0,25 мл (или по пять капель) в каждый носовой ход от трех до шести раз в день. Длительность лечения — 2-3 дня.
Капли в нос для детей в профилактических целях закапывают (по 5 капель) два раза в день, на начальной стадии развития заболевания частоту инстилляций увеличивают: препарат следует вводить не менее пяти-шести раз в сутки через каждые час или два.
Многих интересует можно ли капать в глаза раствор интерферона. Ответ на этот вопрос утвердительный.
Интерферонотерапия: вчера, сегодня и завтра
Для проведения первых исследований ИФН была набрана группа добровольцев, которые согласились ввести себе ИФН, полученные из крови обезьян. В те времена, когда ИФН были мало изучены, для принятия подобного решения требовалась определенная смелость. Поэтому можно сказать, что люди согласились пожертвовать собой ради науки. До введения ИФН их заразили вирусом Коксаки, который вызывает простуду.
По истечению некоторого периода времени было выяснено, что заболел всего лишь один человек из группы добровольцев, несмотря на то, что в назальных смывах вирус присутствовал у всех. При этом побочные эффекты обнаружены не были. Это исследование положило начало тысячам последующих экспериментов, благодаря которым ученые признали способность ИФН защищать человека от болезней.
Тогда же, в 1960-х гг., к исследованию влияния ИФН на организм человека подключились и советские вирусологи. Эпидемиолог Соловьев В.Д. предложил производить ИФН из плацентарной крови, взятой у родильниц. В 1969 году в СССР была зафиксирована эпидемия гриппа Гонконг, с которой впервые пытались бороться при помощи препаратов интерферона, полученных их человеческой крови. Было установлено, что эффективность подобных препаратов составляет почти 70%.
ИФН также широко применялись и в последующие годы – например, в 1973 году, когда за исследования этого вида белков взялся академик Смородинцев А.А. В научных работах тех лет были проанализированы наиболее эффективные методы применения ИФН. Таким образом, путем непрекращающегося изучения ИФН и его влияния на иммунную систему человека к концу XX века ученым удалось накопить колоссальный опыт применения человеческого лейкоцитарного ИФН для профилактики и лечения респираторных инфекций, в том числе гриппа, а также некоторых других вирусных заболеваний.
Интраназально препараты интерферонов широко применялись во многих странах мира, в том числе в Великобритании, США, Японии и Болгарии. В последние годы при лечении детей начинают широко применять интерферон. Для взрослых данная группа препаратов применяется уже более половины века. С началом применения ИФН эффективность защиты от ОРВИ у детей дошкольного возраста, включая новорожденных, значительно повысилась. Это указало ученым на то, что необходимо все глубже изучать ИФН и стремиться расширять область их воздействия, пытаться бороться с помощью ИФН с самыми разными заболеваниями.
Однако, к сожалению, после начала массового производства ИФН достаточно быстро выяснилось, что состав лекарств, содержащих интерферон, является непостоянным даже в рамках производства одной фармацевтической компании. К главным недостаткам препаратов, полученных из донорской крови, относится невозможность очистить препарат на высоком уровне. Оказалось непростым удалить из препарата вирусные частицы. Кроме того, донорская кровь – очень дорогой ингредиент, в больших объемах доступный только единицам фармацевтических компаний. Поэтому сейчас от производства лейкоцитарного ИФН компании почти отказались. Небольшой объем препаратов ИФН, полученных из крови доноров, применяют строго по жизненным показаниям, когда ожидаемая польза значительно превышает возможные риски.
Но неужели, узнав об особенностях лейкоцитарного ИФН, ученые отказались от производства препаратов с интерферонами? Конечно же, нет. В этом случае на помощь пришла биотехнология – наука о способах создания различных веществ с использованием естественных биологических компонентов. Благодаря ей сегодня фармацевты производят рекомбинантные ИФН, абсолютно идентичные природным по аминокислотному составу, для которых не требуется донорская кровь. Эти препараты производятся в больших количествах по всему миру и отличаются относительно низкой стоимостью, что в свою очередь делает цены в аптеках вполне доступными для большинства потребителей.
Препараты ИФН сегодня могут выпускаться в виде высушенного лиофизиата, используемого в дальнейшем для получения раствора, суппозиториев для ректального и вагинального применения, раствора для уколов и ингаляций, капель, мази, геля, аэрозоля, таблеток и микроклизм.
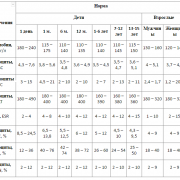
Лекарственные препараты ИФН могут содержать разное количество действующего вещества. На упаковках препаратов это количество чаще всего указывают в международных единицах, или МЕ.
Форму выпуска и дозировку препарата ИФН подбирает лечащий врач, учитывая возраст пациента, его состояние и анамнез.
Интерферон: состав, показания, дозировка, побочные эффекты
- Интерфероны — это биологически активные цитокины, которые синтезируются в различных клетках.
- Их основной функцией служит обеспечение неспецифической противовирусной защиты.
- Но в некоторых случаях организм не в состоянии самостоятельно справиться с инфекцией, и чтобы поддержать иммунную систему и повысить ее активность лучше воспользоваться предназначенными для этого лекарственными препаратами.
Все интерфероны, синтезируемые в организме человека, по функциональной активности подразделяются на два типа:
- Интерфероны α/β обладают ярко выраженным противовирусным действием. Они синтезируются в ответ на инфицирование клеток вирусами и активизируют механизмы защиты близлежащих клеток. Это повышает их устойчивость к патогенной микрофлоре. Интерфероны первого типа синтезируются в лейкоцитах периферической крови, клетках эпителия и фибробластах.
- Интерфероны γ помимо угнетения размножения вируса в организме, обладают и более выраженной по сравнению с цитокинами I группы иммуномодулирующей активностью. Они вовлекают в защитную реакцию различные клетки иммунной системы (лимфоциты, макрофаги, гранулоциты). Причем этот процесс происходит не только на фоне развития какого-либо вирусного заболевания, но и при физическом и психоэмоциональном напряжении, смене биоритмов, переутомлении и т.д. Интерфероны γ типа вырабатываются Т-лимфоцитами.
У ребенка система противовирусной защиты значительно ниже, чем у взрослого человека. Это объясняется низкой способностью лейкоцитов и лимфоцитов к синтезу интерферонов I типа.
Это и определяет восприимчивость детского организма к вирусным респираторным заболеваниям.
В настоящее время в клинической практике используют медикаменты этого типа, полученные как из донорской крови, так и созданные методами генной инженерии (их называют рекомбинантными).
Существует несколько групп препаратов на основе интерферона, в их состав входят цитокины типов α, β, γ.
Лекарственные средства на основе интерферонов β- и γ- типа назначают при серьезных патологиях, например, рассеянном склерозе, ревматоидном артрите, системной красной волчанке, атопическом дерматите, наследственных иммунных заболеваниях.
История применения интерферона для профилактики и лечения ОРВИ берет начало с конца 60-х годов прошлого века.
Дальнейшие достижения молекулярной биологии позволили создать более безопасное, концентрированное и эффективное лекарственное средство.
В настоящее время применяют рекомбинантный человеческий интерферон альфа-2b, полученный генно-инженерным путем.
В состав препарата также входит аминокислота таурин, оказывающая благотворный эффект при воспалительном процессе, независимо от причины его возникновения и локализации.
Таурин является сильным антиоксидантом и препятствует накоплению свободных радикалов в очаге патологии. Помимо этого, аминокислота восстанавливает нормальное течение обменных процессов, что ускоряет выздоровление.
Оригинальный интерферон лейкоцитарный человеческий отечественного производства доступен в ампулах в виде лиофилизата (порошка) для приготовления раствора для инъекций и жидкая форма препарата для интраназального применения и проведения ингаляций.
Стоит отметить, что ранее для приготовления капель в нос разводили порошок в ампулах водой для инъекций и капали полученный раствор детям в нос, хотя подобного способа использования и не указано в инструкции по применению Интерферона.
Они выпускаются в виде ректальных свечей, таблеток, мазей или гелей, спреев.
Но стоит отметить, что подобные формы выпуска, особенно капсулы, обладают системным воздействием на организм и возрастает риск разнообразных нежелательных реакций.
Для плановой профилактики интерферон назначают пациентам, относящимся к группе риска (с иммунодефицитными состояниями и невакцинированным людям) в период эпидемии. Кроме того, как указано в инструкции по применению, Интерферон также показан для экстренной профилактики при непосредственном контакте с больным ОРВИ и при появлении даже невыраженных симптомов заболевания.
Механизм действия
Наиболее изученным свойством интерферона является его способность препятствовать размножению вирусов. Он образуется в клетках млекопитающих и птиц в ответ на вирусную инфекцию.
При заражении клетки вирус начинает размножаться. Клетка-хозяин одновременно с этим начинает продукцию интерферона, который выходит из клетки и вступает в контакт с соседними клетками. Хотя интерферон не обладает прямым противовирусным действием, он способен вызывать такие изменения в клетках, которые препятствуют размножению вируса, формированию вирусных частиц и дальнейшему его распространению. Интерферон действует в нескольких направлениях. Во-первых, он оказывает влияние на клетки, соседние с инфицированной, запуская в них цепь событий, приводящих к подавлению синтеза вирусных белков и в некоторых случаях сборки и выхода вирусных частиц (путём активации олигоаденилатциклазы). В ответ на воздействие интерферона клетки вырабатывают большое количество . Этот фермент фосфорилирует фактор инициации трансляции eIF-2, фосфорилированный eIF-2 формирует неактивный комплекс с другим фактором, eIF-2B. В результате уровень белкового синтеза в клетке снижается. После активируется синтез рибонуклеазы L, которая расщепляет клеточные РНК и ещё больше снижает уровень белкового синтеза. В целом, интерферон-зависимое подавление трансляции является губительным как для вируса, так и для клетки-хозяина. Помимо влияния на трансляцию, интерфероны способны активировать сотни других генов (они известны как гены, стимулируемые интерфероном), играющих роль в защите клетки от вирусов. Кроме того, интерферон лимитирует распространение вирусных частиц путём активации белка p53, что ведёт к апоптотической смерти инфицированной клетки.
Вторым направлением действия интерферонов является стимуляция иммунной системы для борьбы с вирусами. Интерферон повышает синтез молекул главного комплекса гистосовместимости I и II классов и активирует иммунопротеасому. Высокий уровень молекул главного комплекса гистосовместимости I класса обеспечивает эффективную презентацию вирусных пептидов цитотоксическим Т-лимфоцитам и натуральным киллерам, а иммунопротеасома осуществляет процессинг вирусных пептидов, предшествующий презентации. Высокий уровень молекул главного комплекса гистосовместимости II класса обеспечивает презентацию вирусных антигенов Т-хелперам. Т-хелперы, в свою очередь, выделяют цитокины, которые координируют активность других клеток иммунной системы. Некоторые виды интерферонов, например интерферон-γ, могут прямо стимулировать клетки иммунной системы, такие как макрофаги и натуральные киллеры.
Образование интерферона могут стимулировать не только интактные вирусы, но и различные другие агенты, например некоторые инактивированные вирусы, двухцепочечные РНК, синтетические двухцепочечные олигонуклеотиды и бактериальные эндотоксины.
Человеческий лейкоцитарный интерферон во флаконах
Биологическая активность интерферона очень высока. У мышиного интерферона она составляет 2·109 ед./мг, а одна единица снижает образование вирусов примерно на 50 %. Это означает, что достаточно одной молекулы интерферона, чтобы сделать клетку резистентной к вирусной инфекции. Показано, что молекулы интерферона должны оказывать действие на клетку в течение минимум четырёх часов, для того, чтобы в клетке начались процессы борьбы с вирусом, таким образом, многие специалисты не считают эффективным интраназальное применение интерферона для профилактики ОРВИ. Тем не менее, последние исследования на мышах показывают, что интерферон, применённый на слизистую оболочку, может действовать в качестве иммунологического адъюванта против вируса гриппа, усиливая специфический ответ иммунной системы. В США проводятся клинические испытания вакцины против гриппа, которая использует интерферон в качестве адъюванта.
Интерферон вызывает и целый ряд других биологических эффектов, в том числе подавляет размножение клеток.
Нормограмма резистентности.
Механизмы
противомикробной защиты
1.
Понятие противомикробной резистентности
2.
Неспецифическая микробная резистентность
3.
Фагоцитоз
1.
Одним из определяющих факторов,
участвующих в развитии инфекции и
соответственно инфекционных
заболеваний,являетсявосприимчивый
макроорганизм. Совокупность механизмов,
определяющих невосприимчивость
(устойчивость) организма к действию
любого микробного агента, обозначается
термином «противомикробная
(антимикробная) резистентность». Это
одно из проявлений общей физиологической
реактивности макроорганизма, его реакции
на своеобразный раздражитель — микробный
агент.
Противомикробная
резистентность сугубо индивидуальна,
ее уровень определяется генотипом
организма, возрастом, условиями жизни
и труда и т. д.
Повышению
широкого комплекса факторов неспецифической
защиты, в частности, способствуют ранее
прикладывание к груди и грудное
вскармливание.
По
специфичности механизмы противомикробной
зашиты делятся:
-на
неспецифические — первый уровень защиты
от микробных агентов;
-специфические
— второй уровень защиты, обеспечиваемый
иммунной системой. Реализуется следующим
образом:
-через
антитела — гуморальный иммунитет; .
—
через функцию клеток-эффекторов
(Т-киллеров и макрофагов) — клеточный
иммунитет.
Первый
и второй уровни защиты тесно связаны
между собой через макрофаги.
Неспецифические
и специфические механизмы противомикробной
защиты могут быть тканевыми (связанными
с клетками) игуморальными.
2.Неспецифическая
микробная резистентность — это врожденное
свойство макриорганизма, обеспечивается
передаваемыми понаследству достаточно
многочисленными механизмами, которые
делятся на следующие типы:
—
тканевые;
—
гуморальные;
—
выделительные (функциональные).
К
тканевым механизмам неспецифической
естественной противомикробной защиты
относятся:
• барьерная
функция кожи и слизистых оболочек;
• колонизационная
резистентность, обеспечиваемая нормальной
микрофлорой;
• воспаление
и фагоцитоз (может также участвовать в
специфической защите);
•
барьерфиксирующая функция
лимфоузлов;
• ареактивность
клеток;
• функция
естественных киллеров.
Первым
барьером на пути проникновения микробов
во внутреннюю среду организма являются
кожа и слизистые оболочки.Здоровая
неповрежденная кожа и слизистые для
большинства микроорганизмов непроницаемы.
Однако некоторые виды возбудителей
инфекционных заболеваний способны
проходить и через них. Такие возбудители
получили название особо опасных, к ним
относят возбудителей чумы, туляремии,
сибирской язвы, некоторых микозов и
вирусных инфекций. Работа с ними
проводится в специальных защитных
костюмах и только в специально
оборудованных лабораториях.
Помимо
чисто механической функции, кожа и
слизистые оболочки обладают антимикробным
действием — нанесенные на кожу бактерии
(например, кишечная палочка) довольно
быстро погибают. Бактерииидность кожи
и слизистых оболочек обеспечивают:
• ее
нормальная микрофлора (функция
колонизационной рези-стентности);
• секреты
потовых (молочная кислота) и сальных
(жирные кислоты) желез;
• лизоцим
слюны, слезной жидкости и др.
Если
возбудитель преодолевает кожно-слизистый
барьер, то он попадает в подкожную
клетчатку/подслизистый слой, где
реализуется один из основных неспецифических
тканевых механизмов защиты — воспаление.
В результате развития воспаления
происходит:
• отграничение
очага размножения возбудителя от
окружающих тканей;
• его
задержка в месте внедрения;
• замедление
размножения;
• в
конечном счете — его гибель и удаление
из организма.
3.
В ходе развития воспаления реализуется
еще один универсальный тканевой механизм
неспецифической защиты — фагоцитоз.
Явление
фагоцитоза было открыто и изучено
великим русским ученым И. И. Мечниковым.
Итогом
этих многолетних работ стала фагоцитарная
теория иммунитета, за создание которой
Мечников был удостоен Нобелевской
премии.
Фагоцитарный
механизм защиты слагается из нескольких
последовательных фаз:
• узнавание;
• таксис;
• аттракция;
• поглощение;
• киллинг;
• внутриклеточное
переваривание.
Фагоцитоз
со всеми стадиями называется
завершенным.Если фазы киллинга и
внутриклеточного переваривания не
наступают, то фагоцитоз становится
незавершенным. При незавершенном
фагоцитозе микроорганизмы сохраняются
внутри лейкоцитов и вместе с ними
разносятся по организму. Таким образом,
незавершенный фагоцитоз вместо механизма
защиты превращается в его противоположность,
помогая микроорганизмам защищаться от
воздействия макроорганизма и
распространяться в нем.
Роль интерферонов в течении COVID-19: противоречивые данные
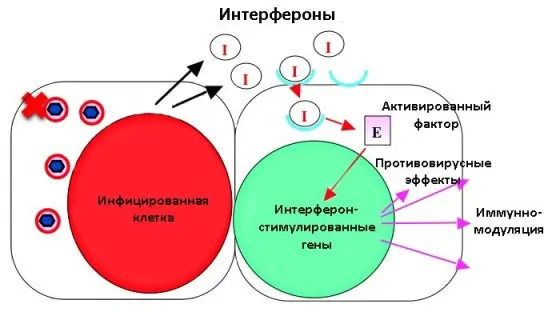
Интерферон I типа – важная часть противовирусной защиты организма. Интерферон активирует множество интерферон-стимулированных генов (ISG), которые позволяют клеткам-хозяевам и соседним с ними клеткам проявлять противовирусную активность.
Многие виды вирусов развили способность обходить противовирусную защиту. В дополнение к этому, SARS-CoV-2 еще и блокирует работу интерферонов I типа (IFN-I).
Механизмы влияния интерферонов на течение COVID-19 изучаются с начала пандемии. Первые исследования обнаруживали пониженный ответ IFN-I на вторжение возбудителя. В то же время, у пациентов в эпителиальных клетках бронхов и легких возрастала экспрессия хемокинов. У пациентов увеличивались уровни провоспалительных цитокинов: интерлейкина-6 (ИЛ-6) и фактора некроза опухоли (ФНО). Результатом этих исследований явилось активное изучение возможности применения генно-инженерного (рекомбинантного) интерферона I типа для лечения COVID-19.
По мере накопления исследовательских данных проявляется обратная ситуация: в ряде случаев наблюдается устойчивый ответ IFN-I при тяжелой форме COVID-19. Анализ транскриптома жидкости бронхоальвеолярного лаважа выявил повышенную экспрессию как провоспалительных цитокинов и хемокинов, так и многочисленных интерферон-стимулированных генов. Изучение РНК одиночных мононуклеарных клеток периферической крови пациентов также продемонстрировало устойчивые уровни IFN-I и ISG.
Противоречивые результаты разных исследований могут быть связаны с методологическими различиями между ними. Тяжелые и критические формы COVID-19 могут обозначаться одинаковыми словами, но описывать разные иммунные состояния. Различия во временных точках отбора проб дополнительно затрудняет сопоставление результатов исследований. Также, не во всех случаях точно указано, что именно имеется в виду под ответом IFN-I: ответ самого интерферона или клеточные ответы на интерферон. Тем не менее, исследования продолжаются.