Состав и структура цинка, а также технологии его производства
Содержание:
- Содержание в организме человека и продуктах питания
- Динамика цен на цинк, прогноз на 2018 год
- Цинковые антифрикционные сплавы
- Цинк в таблетках польза и вред.
- Нахождение в природе
- История
- Химические свойства
- Дефицит цинка
- Свойства металла
- Получение
- Добавки Цинка
- Роль цинка в организме
- Цинк: производство
- Цинк витамины. И швец, и жнец
- История
- Применение цинка:
- Cвинец
- Цинк вред для организма
- Химические, физические свойства и характеристики цинка
- Получение
Содержание в организме человека и продуктах питания
Организм человека обычно содержит около двух граммов цинка. Многие ферменты содержат в себе этот металл. Элемент играет роль в синтезе важных гормонов, таких как тестостерон и инсулин. Элемент крайне необходим для полноценного функционирования мужских половых органов. Кстати, он даже помогает нам справиться с сильным похмельем. С его помощью выводится из нашего организма лишний алкоголь.
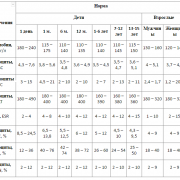
Недостаток цинка в рационе может привести к множеству нарушений функций организма. Такие люди подвержены депрессии, постоянной усталости, нервозности. Дневная норма для взрослого мужчины — 11 миллиграммов в день, для женщины — 8 миллиграмм.
Содержание в продуктах (в миллиграммах на 100 грамм продукта):
- устрицы — 40 мг;
- отруби — 16 мг;
- семена тыквы — 10 ;
- печень говяжья — 8 мг;
- говядина — 8 мг;
- баранина — 6 мг;
- семена подсолнуха — 5 мг;
- сыр — 4 мг;
- овёс — 4 мг;
- курица — 3 мг;
- орехи грецкие — 3 мг;
- фасоль — 3 мг;
- свинина — 3 мг;
- шоколад — 2 мг;
- кукуруза — 0,5 мг;
- бананы — 0,15 мг.
Избыток элемента в человеческом организме также приводит к серьёзным проблемам, поэтому не стоит хранить продукты в цинковой посуде.
Динамика цен на цинк, прогноз на 2018 год
С начала года прослеживается общая отрицательная динамика цен на цинк. Если в феврале 2020 года за тонну металла давали 3577,25 долларов, то по состоянию на 18 мая Лондонская Биржа Металлов (LME) установила курс цинка, равный 3096,50 долларов.
В 2020 году цинк имел статус самого доходного и подходящего для инвестиций металла. В 2020 году отметилась тенденция к снижению инвестиционной привлекательности данного элемента. При этом большинство аналитиков полагают, что цинк в 2020 останется лидером среди цветных металлов.
Deutsche Bank дает прогноз по цинку, в котором предполагается рост цены на металл на 8%. В ближайшие месяцы прогнозируется стоимость тонны металла в пределах 3120-3160 долларов.
Цинковые антифрикционные сплавы
Максимальное распространение имеют антифрикционные материалы. Они применяют как отливки, а также после механической обработки. Эти материалы отличают антифрикционные параметры и довольно высокая прочность. Их применяют для замены бронзы, детали из которой работают при температуре не более 100 градусов Цельсия.
Микроструктура цинковых антифрикционных сплавов
Если температура выше означенной то сплав приобретает излишнюю мягкость и постепенной верхний слой цинковой детали окажется на поверхности вала. Сплавы этого класса используют для получения цельнометаллические или биметаллические материалы. Из сплавов на основе цинка наиболее широкое распространение получили такие сплавы, как ЦАМ1, ЦАМ 4-1, в их составе содержится до 4% алюминия и 1% меди. Кроме, них для получения отливок применяют такие марки, как ЦАМ 10, состоящий на 5% из алюминия и 10% меди. Его отличают высокие механические и антифрикционные свойства. Этот материал широко используется для деталей мотоциклетной техники. Его технические свойства позволяют применять его и в производстве подшипников скольжения. Особняком стоит сплав ЦАМ 4-1. Этот материал используют для получения деталей различной конфигурации и назначения в автомобильной промышленности. Состав этого материала нормирован ГОСТ 19424-97. В соответствии с его требованиями в состав этого сплава, кроме алюминия и меди, могут входить:
- кремний, не более 0,13%;
- магний, не более 0,06%;
- железо, не более 0,005%;
- свинец, не более 0,01%;
- олово, не более 0,012%;
- кадмий, не более 0,004%.
Применение цинковых антифрикционнх сплавов
Свойства и характеристики сплава отличаются от множества других сплавов, так, ЦАМ 4-1, имеет плотность, превышающую 7,1 кг на 1 дм, предел текучести лежит в пределах 100 КГс и рядом других. Для получения деталей из цинка ЦАМ 4-1, последний поступает в чушках, весом по 25 кг каждая, допустимо и применение материала – сырца в чушках по 500 кг.
Цинк в таблетках польза и вред.
В период гриппа и простуд все более актуальной становится необходимость приема специальных витаминных комплексов. Зачастую их выбор основывается на общих знаниях о пользе тех или иных биологически активных элементов. Так, признанными «борцами» за крепкий иммунитет признаются аскорбиновая кислота и рибофлавины. Но для здорового функционирования организма требуются и другие витамины, участвующие в важнейших иммунных процессах. К числу «непризнанных», но важных органических (химических) соединений, относится цинк, о котором мы сейчас и будем говорить.
Свойства цинка
Данный микроэлемент участвует едва ли не во всех основных процессах жизнедеятельности организма человека: в образовании костной ткани, формировании активного витамина А, усилении противовоспалительного действия ряда медицинских препаратов, регенерации клеток тканей разных органов после перенесения тяжелых заболеваний. В медицинской практике существует особая программа по восстановлению функций организма для лиц, перенесших длительные операции с использованием химиотерапии. Больным прописывается цинк в таблетках – источник устойчивых, биологических «сил» организма человека.
Нужно еще добавить, что без участия цинка невозможно образование активных мужских половых клеток и, кроме того, возрастает риск развития аденомы предстательной железы. Необходимость приема этого витамина актуальна и для женщин. Дефицит цинка оказывает негативное влияние на развитие плода, «затормаживает» физическое и умственное развитие детей (особенно мальчиков). Избежать нездоровых последствий можно благодаря сбалансированному питанию и приему специфических препаратов.
Сторонникам натурального обогащения организма полезными макро- и микроэлементами, специалисты советуют использовать поликомпонентное питание. Ему соответствует регулярное сочетание рыбы, мяса, овощей, фруктов, ягод и орехов. Наибольшее количество цинка присутствует в продуктах животного происхождения (печени, мясе), а также семенах некоторых растений (подсолнечника, тыквы).
Прием цинка в таблетках крайне необходим при соблюдении человеком норм строгого вегетарианства, исключающего любые «животные» продукты. При этом замещение мяса и рыбы исключительно бобовыми растениями и, например, орехами может привести к развитию аллергических реакций и диатезу.
Кому цинк противопоказан?
Грамотное пищевое поведение, сбалансированный рацион – гарантия адекватной адаптации микроэлементов в организме человека. Другими словами, полученные с пищей витамины усвоятся ровно в том количестве, которое необходимо здоровому функционированию всех органов. Избыток органических соединений при этом исключен.
Превышение показателя цинка – следствие не гастрономических пристрастий, а возможного развития ряда заболеваний. К ним относятся:
- костная остеосаркома
- коронарные сердечные патологии
- анемия
Диагностирование данных недугов отменяет необходимость приема цинка в таблетках, а также препаратов класса пеницилламин (противовоспалительные, иммуномодулирующие средства).
Отказ от цинкосодержащих витаминных комплексов показан людям, чья профессиональная деятельность связана с производством, в которых используются тяжелые металлы, лакокрасочные материалы
Эта мера предосторожности продиктована необходимостью сократить целенаправленное поступление в организм цинка и ряда других соединений, поскольку избежать парообразного проникновения металлов в данном случае оказывается невозможно
Недостаток любого витамина в организме – это тяжелое испытание для работы иммунной системы
Участие цинка в наиболее значимых процессах жизнедеятельности объясняет его исключительную важность и необходимость для здоровья человека. В ряде случаев пищевой путь получения данного микроэлемента оказывается недостаточным
Сократить дефицит цинка можно благодаря использованию специфических биологически активных добавок. При этом важно соблюдать необходимую дозировку и не превышать сроков проведения «цинко-терапии». Избыток данного элемента может стать причиной возникновения новых заболеваний.
Нахождение в природе
Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространённый минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.

Сфалерит
Среднее содержание цинка в земной коре — 8,3·10-3%, в основных извержённых породах его несколько больше (1,3·10-2%), чем в кислых (6·10-3%). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом
Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Цинк — важный биогенный элемент, в живых организмах содержится в среднем 5·10-4% цинка. Но есть и исключения — так называемые организмы-концентраторы (например, некоторые фиалки).
Месторождения
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл»[неавторитетный источник?].
История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии был запатентован дистилляционный способ получения цинка. В промышленном масштабе выплавка цинка началась также в XVIII в.: в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом. В А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка.
В 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C . Первый в России цинк был получен на заводе «Алагир» 1 января 1905 года. Первые заводы, где цинк получали электролитическим способом, появились в 1915 году в Канаде и США.
Химические свойства
Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
-
- 2Zn+O2→2ZnO{\displaystyle {\mathsf {2Zn+O_{2}\rightarrow 2ZnO}}}
Оксид цинка реагирует как с растворами кислот:
-
- ZnO+2HCl→ZnCl2+H2O{\displaystyle {\mathsf {ZnO+2HCl\rightarrow ZnCl_{2}+H_{2}O}}}
так и щелочами:
-
- ZnO+2NaOH+H2O→Na2Zn(OH)4{\displaystyle {\mathsf {ZnO+2NaOH+H_{2}O\rightarrow Na_{2}}}}
Цинк обычной чистоты активно реагирует с растворами кислот:
-
- Zn+2HCl→ZnCl2+H2↑{\displaystyle {\mathsf {Zn+2HCl\rightarrow ZnCl_{2}+H_{2}\uparrow }}}
и растворами щелочей:
-
- Zn+2NaOH+2H2O→Na2Zn(OH)4+H2↑{\displaystyle {\mathsf {Zn+2NaOH+2H_{2}O\rightarrow Na_{2}+H_{2}\uparrow }}}
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Дефицит цинка
может произойти при определенных состояниях пищеварения, таких как синдром протекающей кишки.
Вы получаете достаточно цинка?
Если вы хотите, чтобы в вашу систему поступало много цинка, этот минерал в основном содержится в продуктах с высоким содержанием белка, включая мясо, морепродукты и молочные продукты.Цинк в бобовых и зерновых культурах также не так хорош для вас, как цинк, содержащийся в животных белках, из-за присутствия антинутриентов, которые могут препятствовать усвоению цинка.
Факторы риска
Так вы рискуете дефицитом цинка? Вегетарианцы и веганы подвергаются большему риску, чем люди, которые едят мясо просто потому, что их диета, как правило, не содержит достаточно высокого качества цинка. Считается, что женщины, принимающие противозачаточные таблетки и те, кто проходит заместительную гормональную терапию, более склонны к дефициту цинка.
Дефицит цинка симптомы
- Потеря веса или увеличение веса.
- Изменения в аппетите человека, которые могут включать тягу к сладкой или соленой пище.
- Проблемы с запахом и вкусом.
- Потеря волос
- Различные проблемы с пищеварением, включая расстройство желудка, судороги и диарею
- Хроническая усталость
- бесплодие
- Плохой иммунитет
- Проблемы с памятью и концентрацией
- Гормональные проблемы, такие как ухудшение симптомов менопаузы и ПМС.
- Неспособность раны эффективно заживать
- Нервная дисфункция
Свойства металла
Наш хрупкий герой — переходный металл синевато-белого цвета. На воздухе быстро окисляется, темнеет от пленки оксида.
В таблице Менделеева этот химический элемент находится в 12 группе (по старой классификации во II группе четвертого периода).
Особенности цинка:
- атомный номер 30;
- атомная масса 65,38 г/моль;
- металлический блеск;
- непрозрачность;
- плотность 7,14 г/см3;
- структура кристаллической решетки гексагональная.
Химические свойства цинка обусловлены его «темпераментом». До щелочноземельных металлов ему далековато, но в реакции он вступает охотно. В реакциях проявляет степени окисления 0; +2.
- Цинк хороший восстановитель и активный металл.
- Наш герой охотно реагирует с разбавленной азотной кислотой, с концентрированными серной и азотной кислотами.
- С галогенами в присутствии паров воды может воспламениться.
- С растворами щелочей образует гидрокомплексы.
- При температуре красного каления (550-600°С) вступает в реакцию с водой, с сероводородом. При реакции выделяется водород.
Взаимодействие с металлами происходит в расплавленном состоянии, но это мало касается химических реакций.
| Свойства атома | |
|---|---|
| Название, символ, номер | Цинк / Zincum (Zn), 30 |
| Атомная масса (молярная масса) |
65,38(2) а. е. м. (г/моль) |
| Электронная конфигурация | 3d10 4s2 |
| Радиус атома | 138 пм |
| Химические свойства | |
| Ковалентный радиус | 125 пм |
| Радиус иона | (+2e) 74 пм |
| Электроотрицательность | 1,65 (шкала Полинга) |
| Электродный потенциал | -0,76 В |
| Степени окисления | 0; +2 |
| Энергия ионизации (первый электрон) |
905,8(9,39) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,133 г/см³ |
| Температура плавления | 419,6 °C |
| Температура кипения | 906,2 °C |
| Уд. теплота плавления | 7,28 кДж/моль |
| Уд. теплота испарения | 114,8 кДж/моль |
| Молярная теплоёмкость | 25,4 Дж/(K·моль) |
| Молярный объём | 9,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,6648 c=4,9468 Å |
| Отношение c/a | 1,856 |
| Температура Дебая | 234 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 116 Вт/(м·К) |
| Номер CAS | 7440-66-6 |
Физические свойства цинка:
- Температуры плавления и кипения равны соответственно 427 и 907 ºС.
- Нагрев до 100-150 градусов дает возможность прокатки и вытягивания металла; чем больше примесей в металле, тем более хрупким он становится.
- Хотите услышать «оловянный крик» — сгибайте и разгибайте пруток или металлическую пластинку. Правда, на крик это мало похоже, скорее треск или скрип. Но для незамысловатого фокуса на вечеринке сойдет.
В природе металл состоит из пяти изотопов:
- Zn64;
- Zn66;
- Zn67;
- Zn68;
- Zn70.
Смесь металлов — это сплав
Сплавы для промышленного использования содержат Zn-Al и Zn-Al-Cu. Почти всегда в состав добавляется магний (не более 0,1%). Сплавы цинка делятся на антифрикционные и литейные.
- Марки антифрикционных сплавов: ЦАМ9-1,5; ЦАМ10-5.
- Литейные марки: ЦА4, ЦА4М1, ЦА30М5.
Получение
Цинк в природе как самородный металл не встречается.
Цинк добывают из полиметаллических руд, содержащих 1—4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьём. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка — 99,95 %, полнота извлечения его из концентрата (при учёте переработки отходов) — 93—94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Добавки Цинка
- Ацетат цинка, глюконат цинка, Цинк-гистидин, пиколинат цинка и сульфат цинка в виде таблеток, капсул, мазей доступны в качестве биологически активных добавок.
- Цинк также может быть включен в поливитаминные / минеральные добавки.
Преимущества Цинка
- Профилактика и лечение дефицита цинка
- Лечение акродермита
- Уменьшение диареи для недоедающих детей или в детей которые имеют низкие уровни цинка
- Повышение уровня витамина А у недокормленных детей или у детей с низким уровнем цинка
- Стимулирование роста и снижение смертности детей в районах с общим дефицитом цинка
- Профилактика и лечение пневмонии у недоедающих детей в развивающихся странах
- Лечение болезни Вильсона
простудных
Роль цинка в организме
От цинка зависит очень многое.
-
Синтез белков, основного строительного материала любого биологического организма. Этой функцией обусловлены и другие полезные свойства цинка.
-
Иммунный ответ, то есть синтез белков, которые контратакуют инфекции или токсины. Соответственно, если белка не хватает, иммунитет слабеет.
-
Крепкие кости (ногти и волосы): ответственный за это кальций откладывается в матрицу, выстроенную из белков, для которых опять-таки необходим цинк. Некоторые препараты кальция снижают усвояемость цинка, что делает их прием бессмысленным.
-
Мужская сила и женское счастье: дефицит цинка — одна из самых распространенных причин эректильной дисфункции и мужского бесплодия. Так что мужчин надо подкармливать цинком. Типично мужская диета — много мяса и минимумом быстрых углеводов.
-
Вкус и обоняние. С цинком, оказывается, жизнь веселее и вкуснее. А его серьезный недостаток вызывает развитие анорексии и булимии.
-
Усвоение глюкозы. Именно при участии цинка в печени работает фермент, который помогает глюкозе превратиться в энергию. Если цинка слишком мало, глюкоза откладывается в виде жира.
-
Еще одно ценное свойство цинка — в составе специального фермента расщеплять алкоголь и снижать таким образом его негативное действие.
-
С синтезом белков связана и колоссальная польза цинка для кожи: он помогает очищать ее от инфекций, заживлять и восстанавливать, защищать от внешних воздействий, начиная с тех же инфекций и заканчивая ультрафиолетом.
Цинк: производство
Главное сырье для добычи цинка – это полиметаллическая руда, содержащая сульфид Zn в количестве 1-4 %. В дальнейшем это сырьё обогащается селективной флотацией, позволяющей получить цинковый концентрат (до 50-60 % Zn). Его помещают в печи, превращая сульфид в оксид ZnO. Затем обычно применяется дистилляционный (пирометаллургический) способ получения чистого Zn: концентрат обжигается и спекается до состояния зернистости и газопроницаемости, после чего восстанавливается коксом или углем при температуре 1200-1300°C. Простая формула показывает, как из оксида цинка получить цинк:
ZnO+С=Zn+CO
Данный способ позволяет добиться 98,7-процентной чистоты металла. Если же необходима чистота в 99,995%, применяется технологически более сложная очистка концентрата ректификацией.

Цинк витамины. И швец, и жнец
Перечисляя все функции цинка в организме, легко сбиться со счета. Ведь этот микроэлемент трудится практически на всех фронтах. Вот лишь главные его функции:
Укрепление иммунитета, защита от инфекций. Цинк – это естественный иммуномодулятор. При нехватке цинка в крови поднимается уровень кортизола – гормона, подавляющего иммунитет и разрушающего мышечные волокна. Если пить цинк в сочетании с витамином С в холодное время года, можно уберечься от гриппа и ОРВИ.
Участие в образовании костной ткани . Наряду с кальцием этот микроэлемент необходим для формирования и укрепления зубов и костей как у детей, так и у взрослых.
Улучшение работы мозга. Кора головного мозга, недополучая цинк, начинает давать сбой, что может выражаться в появлении галлюцинаций, потере вкуса, нарушении обоняния и даже возникновении эпилептических припадков. Существует связь между содержанием в организме цинка и умственными способностями человека. Исследования показали, что у хорошо успевающих студентов в волосах содержится больше цинка, чем у отстающих. Особенно важен цинк для отделов мозга, отвечающих за концентрацию внимания и память.
Стимуляция половой системы. Мужчинам этот минерал необходим для производства спермы и синтеза тестостерона, а также для профилактики аденомы предстательной железы, а женщинам – для хорошей работы яичников и здорового гормонального фона.
Укрепление зрения. Участвуя в биохимических реакциях сетчатки, цинк помогает усваивать витамин А, важный для нормальной работы глаз. А при его недостатке может развиться катаракта и блефарит.
История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии был запатентован дистилляционный способ получения цинка. В промышленном масштабе выплавка цинка началась также в XVIII в.: в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом. В А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка.
В 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C . Первый в России цинк был получен на заводе «Алагир» 1 января 1905 года. Первые заводы, где цинк получали электролитическим способом, появились в 1915 году в Канаде и США.
Применение цинка:
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
- https://en.wikipedia.org/wiki/Zinc
- https://de.wikipedia.org/wiki/Zink
- https://ru.wikipedia.org/wiki/Цинк
- http://chemister.ru/Database/properties.php?dbid=1&id=240
- https://chemicalstudy.ru/tsink-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: Фото https://www.pexels.com, https://pixabay.com
карта сайта
цинк атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решеткаатом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома электронные формулы сколько атомов в молекуле цинкасколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
578
Cвинец
Чистый свинец (Pb) — серебристый металл, тяжёлый и легкоплавкий, имеющий синеватый отблеск. Свинец — относится к легкоплавким металлам. Температура плавления свинца невысока и составляет всего 327 °С (плавится в домашних условиях на газовой плите).
Свинец обладает удивительной мягкостью — именно в чистом виде этот металл можно без особых усилий резать ножом. На воздухе свинец тускнеет, покрываясь тонкой плёнкой оксида свинца PbО или основного карбоната свинца Pb3(ОН)2(СО3)2. При комнатной температуре свинец инертен по отношению к соляной и серной кислотам, так как покрывается защитной плёнкой из нерастворимой соли, зато легко вступает в реакцию с азотной, а на воздухе — даже со слабой уксусной кислотой: 2Pb+4СН3СООН+О2=2Pb(СН3СОО)2+2Н2О. Образующийся в результате этой реакции ацетат свинца называют свинцовым сахаром
за его сладкий вкус. Однако убеждаться в этом самому не следует: всесоединения свинца , в особенности растворимые в воде, крайне ядовиты. Сильное отравление наступает уже при попадании в организм 0,3 г соединений свинца.
Цинк вред для организма
Цинк для организма: польза и чем может быть вреден
Цинк – химический элемент, металл, символ Zn. Многие из нас когда-то использовали для покраски цинковые белила, и почти все знакомы с оцинкованной посудой. А оцинкованное железо и сегодня применяется как кровельный материал. Из школьного курса химии некоторые помнят, что серые гранулы этого металла растворяются в кислотах. В то же время широко известна цинковая мазь.
Последнее время цинк все больше получает известность в качестве полезной добавки в рационе. Иногда такая популярность приводит к тому, что им начинают пользоваться как лекарством. Но это всего лишь микроэлемент, который нужен организму в небольших количествах.
Свойства и роль в организме
В чистом виде цинк представляет собой серебристо-белый металл . В организме он находится в виде растворимых соединений с органическими молекулами. Этот элемент способен образовывать с ними крупные комплексы – и в таком виде входит в состав подавляющего большинства ферментов.

Ферменты – крупные молекулы белков, из нескольких сотен или тысяч атомов, имеющие в составе активные центры металлов. Это природные катализаторы, которые ускоряют и делают возможными важнейшие процессы в организме. Например, они участвуют в синтезе гормонов, расщепляют белки и жиры, поступающие с пищей, участвуют в нейтрализации токсинов. Цинк входит в состав более 300 различных ферментов .
Потребность человека и содержание в продуктах
В организме взрослого человека находится 1,5–2 грамма цинка . Больше всего этого металла присутствует в скелетных мышцах, печени, коже, волосах и ногтях.
Потребность в цинке составляет 8–10 мг в сутки у женщин и 12–15 у мужчин. У мужчин она выше, так как цинк отвечает за синтез тестостерона. Но и женщинам в ряде случаев нужно больше этого элемента – он требуется для работы репродуктивной функции. Поэтому у беременных женщин потребность в нем возрастает до 15–16 мг.
Больше всего цинка содержат:
- Устрицы и другие морепродукты.
- Мясо – 5–8 мг элемента на 100 грамм.
Из растительной пищи:
- Какао-порошок (7 мг).
- Тыквенные семечки (10 мг), кунжут (7 мг), подсолнечные семечки (5 мг).
- Орехи – кешью, кедровый (5 мг), грецкий (3 мг).
- Соя, чечевица (4-5 мг), фасоль (3,5 мг).
- Отруби (7 мг), мука грубого помола (3 мг), зерновой хлеб, ростки пшеницы.

Польза цинка
- Входит в ферменты, отвечающие за синтез тестостерона – мужского гормона. Поэтому цинк относится к микроэлементам, необходимым для нормальной работы мужской половой функции. В частности, требуется для выработки спермы, нормальной работы предстательной железы и т.п.
- Требуется при синтезе гормона роста соматотропина , поэтому нужен в большом количестве беременным и кормящим женщинам.
- Повышает иммунитет , препятствуя развитию многих инфекционных заболеваний. Иногда его называют главным элементом, отвечающим за иммунитет, так как он необходим для образования клеток, уничтожающих вирусы – фагоцитов.
- Входит в состав известного гормона инсулина , который отвечает за уровень сахара в крови. У больных сахарным диабетом содержание цинка в крови ниже, чем у других людей.
- Участвует в поддержании структуры ногтей и волос , нужен для их нормального роста. Выпадение волос может говорить о недостаточном присутствии цинка в организме.
- Задействован в процессах кроветворения . При дефиците цинка снижается концентрация эритропоэтина – гормона, вырабатывающего красные кровяные тельца. А если его образуется недостаточно, начинается анемия.
- Требуется для нормального усвоения организмом витамина Е (токоферол). Обеспечивает нужную концентрацию витамина Е в крови.
- Полезен для глаз , так как его достаточное количество в рационе предотвращает глазные заболевания.
Химические, физические свойства и характеристики цинка
Цинк – металл, обладает рядом свойств и характеристик, отличающих его от иных элементов периодической таблицы.
К физическим свойствам цинка относится его состояние. Основным фактором выступает температурный режим. Если при комнатной температуре это хрупкий материал, плотность цинка 7130 кг/м 3 (˃ плотности стали), который практически не гнётся, то при повышении он легко изгибается и прокатывается в листах на заводах. Если взять более высокий температурный режим – материал приобретает жидкое состояние, а если еще поднять температуру на 400-450 °С градусов, тогда он просто испарится. В этом уникальность – менять своё состояние. Если же подействовать кислотами и щелочами, он может рассыпаться, взорваться, расплавиться.

Цинк в жидком состоянии
Формула цинка Zn – zincum. Атомная масса цинка 65.382 а.е.м.
Электронная формула: ядро атома металла содержит 30 протон, 35 нейтрон. В атоме 4 энергетических уровня – 30 электронов. (рис. строение атома цинка)1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 .
Кристаллическая решётка цинка – шестиугольная кристаллическая система с плотно прижатыми атомами. Данные решётки: A=2.66У, С=4.94.
Получение
Цинк в природе как самородный металл не встречается.
Цинк добывают из полиметаллических руд, содержащих 1—4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьём. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка — 99,95 %, полнота извлечения его из концентрата (при учёте переработки отходов) — 93—94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.