Микробиологические методы исследования воды, почвы, воздуха
Содержание:
- Связь с другими науками
- Объекты санитарно-микробиологического исследования на стерильность. Методы отбора проб и их исследование. Интерпретация результатов санитарно-микробиологических исследований на стерильность
- Бизнес и финансы
- Приказ 535 «Об унификации микробиологических методов исследования»
- Посев на плотные среды
- Отбор образцов
- Забор и транспортировка
- Регламентирующие документы
- Санитарно-микробиологическое исследование мяса и мясных продуктов. Критерии микробиологической безопасности
- Почва
- Как происходит взятие материала
- Для определения каких микроорганизмов чаще всего проводятся бактериальные посевы
- Справочная информация
- 2.1. Понятие о санитарно-показательных микроорганизмах
- Острые кишечные инфекции
- Бактериоскопический метод исследования
- Микробиологический анализ мочи
- Какие бактерии выявляют?
- Подсчет клеток на фиксированных мазках
- Что это за исследование и для чего проводится?
- Последовательность действий и особенности методики
- Воздух
Связь с другими науками
За время существования микробиологии сформировались общая, техническая, сельскохозяйственная, ветеринарная, медицинская, санитарная ветви.
- Общая изучает наиболее общие закономерности, свойственные каждой группе перечисленных микроорганизмов: структуру, метаболизм, генетику, экологию и т. д.
- Техническая занимается разработкой биотехнологии синтеза микроорганизмами биологически активных веществ: белков, нуклеиновых кислот, антибиотиков, спиртов, ферментов, а также редких неорганических соединений.
- Сельскохозяйственная исследует роль микроорганизмов в круговороте веществ, использует их для синтеза удобрений, борьбы с вредителями.
- Ветеринарная изучает возбудителей заболеваний животных, методы диагностики, специфической профилактики и этиотропного лечения, направленного на уничтожение возбудителя инфекции в организме больного животного.
- Медицинская микробиология изучает болезнетворные(патогенные) и условно-патогенные для человека микроорганизмы, а также разрабатывает методы микробиологической диагностики, специфической профилактики и этиотропного лечения вызываемых ими инфекционных заболеваний.
- Санитарная микробиология изучает санитарно-микробиологическое состояние объектов окружающей среды, пищевых продуктов и напитков, и разрабатывает санитарно-микробиологические нормативы и методы индикации патогенных микроорганизмов в различных объектах и продуктах.
Объекты санитарно-микробиологического исследования на стерильность. Методы отбора проб и их исследование. Интерпретация результатов санитарно-микробиологических исследований на стерильность
Пробы отбирают
методом смыва стерильным ватным тампоном,
помещенным в пробирки с пептонной
водой. Перед взятием пробы тампоны
увлажняют. Для проведения смывов с рук
увлажненным ватным тампоном протирают
руки обследуемого. Перед исследованием
смывную жидкость с тампоном или салфеткой
встряхивают в течение 10 мин для десорбции
микроорганизмов и далее смывную жидкость
используют для посевов.
Методика
исследования.Определение
БГКП.
Определение
Staphylococcusaureus.
1
мл смывной жидкости засевают в
пробирку солевого бульона, инкубируют.
При наличии роста высевают на желточно
– солевой агар для получения изолированных
колоний.
Требования
к микробиологической чистоте: присутствие
БГКП, синегнойной палочки, протеев,
стафилококка в смывах не
допускается.
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Приказ 535 «Об унификации микробиологических методов исследования»
Бактериологический анализ занимает важнейшее место в комплексе клинико-лабораторных мероприятий, направленных на диагностику, профилактику и лечение разнообразных инфекционных заболеваний. Однако исследованием окружающей среды они не ограничиваются.
Особое значение имеет бактериологический анализ биологического материала в лечебных учреждениях. К исследованиям, проводимым в медучреждениях, предъявляются повышенные требования. Целью Приказа «Об унификации микробиологических методов исследования» является совершенствование бактериологического анализа, повышение качества и эффективности микробиологической диагностики.
Посев на плотные среды
Микроскопические методы микробиологического исследования позволяют выявить большое количество микроорганизмов. Но, несмотря на это, метод посева считается наиболее распространенным в практике. Суть его состоит в высеве объема препарата (почвенной суспензии) в чашке Петри на плотную среду.
Этот метод микробиологического исследования позволяет учитывать не только количество, но и групповой, а в ряде случаев и видовой состав микроскопической флоры. Подсчет числа колоний производится, как правило, со дна чашки Петри в проходящем свете. На подсчитанном участке ставится точка маркером либо чернилами.
Отбор образцов
При анализе пахотной почвы, как правило, пробы берут с глубины всего слоя. Сначала удаляется 2-3 см сверху грунта, так как в нем может присутствовать посторонняя микрофлора. После этого с изучаемого участка грунта берут монолиты. Длина каждого из них должна соответствовать толщине слоя, из которого нужно взять образец.
На участке в 100-200 кв. м отбирается 7-10 проб. Вес каждой – порядка 0.5 кг. Пробы необходимо тщательно перемешать в мешке. После этого берут средний образец, весом приблизительно 1 кг. Его следует поместить в пергаментный (стерильный) пакет, вложенный в тканевый мешок. До непосредственного анализа образец хранится в холодильнике.
Забор и транспортировка
Для проведения исследования требуется правильно подготовить воду. Ее забор делается по схеме:
- Берется только стерильная бутылка.
- Водопроводный кран, откуда будет делаться забор воды, предварительно обжигается.
- Из крана на протяжении 7-10 минут должна сливаться вода. Только после этого ее можно набирать в стерильную емкость.
- Тара наполовину набирается водой, закрывается пробкой и перевозится в лабораторию. При этом вода при доставке к месту анализа не должна контактировать со стерильной пробкой.
Для исследования подходит только та вода, с момента забора которой прошло не больше 1,5 часа.
Сам анализ проводится по следующему плану:
- Осуществляют подготовку лабораторной посуды и всех материалов. Вся посуда стерилизуется, промывается и тщательно сушится. Стерилизация происходит в сушильном шкафу. Температура внутри него должна быть порядка 160-165С. Посуда обрабатывается сухим жаром на протяжении часа. Вместо сушильного шкафа может применяться автоклав. В нем температура ниже – порядка 126С. Обработка длится полчаса.
- Простерилизованную посуду вынимают из шкафа только после того, когда он остынет до температурных значений меньше 60С.
- Обработанную посуду помещают в лабораторные шкафы. Они должны плотно закрываться.
- Готовят стерильную воду. Сначала исследуемая вода разливается по флаконам, которые закрываются пробками. После этого флаконы с водой стерилизуются в автоклаве в течение 20 минут при температуре 120С. Такая вода пригодна для использования в течение 2 недель.
- Готовят питательную среду. Ее компонентами может быть как мясной бульон, так и глюкоза, лактоза или фильтрованная желчь скота.
- Готовят химические реактивы для конкретного анализа.
- Подготовленную питательную среду ставят на водяную баню, после чего охлаждают до 45-50С.
- Расставляют стерильные чаши с пометками.
- Берут несколько проб питательной среды и делают два посева в стерильные чаши.
- Колбы со взятой для анализа воды открывают, обжигают их горлышки и немного продувают их воздухом через пипетку. Она должна быть стерильной.
- Чистой палочкой делается забор воды. Она добавляется в стерильные чаши, которые закрываются пробкой.
- Взятая вода заливается остуженным питательным раствором. Чаша со смесью быстро перемешивается вращательными движениями. Далее чаша ставится на ровную поверхность. Смесь внутри нее должна застыть.
- Чаша с застывшим раствором переворачивается вверх дном и ставится в термостат. Там создается оптимальная среда для выращивания посевов (37С). Чаша находится в термостате сутки.
- Чаша с выращенными колониями микроорганизмов кладется на затемненный фон вверх дном. При помощи лупы делается подсчет количества появившихся колоний бактерий. При подсчетах учитывается число микроорганизмов на 1 см3 взятой для анализа воды.
- Результаты фиксируются в протоколе и регистрационном журнале. Дополнительно фиксируются особые условия, при которых проходил анализ.
Регламентирующие документы
Чтобы анализ соответствовал требованиям государства, его регламентируют законы, указанные в таблице:
| Нормативный акт | |
| СанПиН 2.1.4.559-96 | Требования для питьевой воды, централизованных систем подачи водоснабжения. Прописывают правила поддержания контроля качества |
| СанПиН 2.1.4. 1074-01 | Нормативы содержания патогенных микроорганизмов для разных источников воды |
| Санитарные правила 1.2.731-99 | Правила работы с патогенными бактериями 3, 4 группы, гельминтами |
| ГОСТ 18963-73 | Прописаны методы микробиологического анализа питьевой воды |
| ГОСТ 25151-82, 27065-86 | Описаны стандарты качества различных вод и водоснабжения |
Санитарно-микробиологическое исследование мяса и мясных продуктов. Критерии микробиологической безопасности
При микроскопическом
исследовании мяса определяют количество
бактерий в мазках-отпечатках, которые
готовят из кусочков мяса. Мазки
окрашивают по Граму и микроскопируют.
Мясо считается свежим, если в поле зрения
обнаружено не более 10 бактериальных
клеток.
Бактериологическое
исследование мясных продуктов:
определяют микробное число, а также
устанавливают присутствие БГКП,
сальмонелл, бактерий рода Proteus,
стафилококков и клостридий.
Для
определения общего
количества микроорганизмов
в 1 г продукта делают посев 0,1 и 0,01 г
продукта на питательный агар, инкубируют
48ч и подсчитывают число колоний.
Для определения
БГКП в 1 г продукта производят
посев 5 мл взвеси на элективно —
дифференциальную среду для БГКП и
содержит питательный. При росте
лактозоположительных БГКП синий цвет
меняется на темно-зеленый или
ярко-желтый.
Почва
Она рассматривается учеными как один из возможных путей передачи инфекционных патологий. С выделениями больных людей или животных в почву проникают патогенные микроорганизмы. Некоторые из них, в частности, споровые, способны сохраняться в грунте продолжительное время (иногда несколько десятков лет). В почву попадают возбудители таких опасных инфекций, как столбняк, сибирская язва, ботулизм и пр. Методы санитарно-микробиологического исследования почвы позволяют определить «микробное число» (кол-во микроорганизмов в грамме грунта), а также коли-индекс (количество кишечных палочек).
Как происходит взятие материала
Анализ сдается как минимум через 10 суток после окончания антибиотикотерапии. Перед забором материала нельзя мыть место его взятия гелем или мылом с антибактериальными компонентами.
Процедура зависит от материала, который берется на диагностику:
- Моча собирается утром после подмывания половых органов без использования антибактериального мыла. Образец собирается в чистую емкость в объеме примерно 10-15 мл и сразу доставляется в лабораторию. Образцы, взятые с клеенок и суден, не подходят из-за бактериальной загрязненности.
- Перед взятием мазков из половых путей нельзя спринцеваться, вводить свечи и гели. Материал не собирается во время критических дней.
- Образец на анализ кала берется утром специальной лопаткой в чистую посуду в объеме примерно 30 мг. Нельзя использовать кал, взятый у детей из подгузников, полученный с помощью клизм и слабительных средств.
- Мокроту собирают в специальную чашечку после чистки зубов и полоскания полости рта. Анализ из носоглотки и горла берется медперсоналом клиники.
- Грудное молоко собирают после мытья груди и обработки околососковой зоны спиртом. Первые капли сцеживаются, чтобы промыть молочные протоки, а затем собирается 15 мл в пробирку.
- Мазок из уретры у мужчин берется врачом-урологом. Перед этим в течение 5-6 часов желательно воздержаться от мочеиспускания, иначе урина смоет микробов, и результат будет неточным.
Для определения каких микроорганизмов чаще всего проводятся бактериальные посевы
- Разнообразной кокковой флоры, вызывающей гнойное поражение половых путей, органов дыхания, ЛОР-органов, нагноения ран и язв.
- Дифтерийной палочки – возбудителя опасной болезни – дифтерии, поражающей дыхательные пути, глаза, нос.
- Возбудителей кишечных инфекций – кишечную палочку, дизентерийную группу, брюшнотифозные бактерии, возбудителей паратифа, сальмонеллу, иерсинию.
- Разнообразных микробов, вызывающих урогенитальные патологии и половые инфекции – гонококк, микоплазму, уреаплазму, трихомонаду, грибок молочницы.
- Кроме того, высевают возбудителей, которые могут вызывать различные заболевания – энтеробактерии, гемофильные микроорганизмы, клебсиеллы.
Справочная информация
ДокументыЗаконыИзвещенияУтверждения документовДоговораЗапросы предложенийТехнические заданияПланы развитияДокументоведениеАналитикаМероприятияКонкурсыИтогиАдминистрации городовПриказыКонтрактыВыполнение работПротоколы рассмотрения заявокАукционыПроектыПротоколыБюджетные организацииМуниципалитетыРайоныОбразованияПрограммыОтчетыпо упоминаниямДокументная базаЦенные бумагиПоложенияФинансовые документыПостановленияРубрикатор по темамФинансыгорода Российской Федерациирегионыпо точным датамРегламентыТерминыНаучная терминологияФинансоваяЭкономическаяВремяДаты2015 год2016 годДокументы в финансовой сферев инвестиционной
2.1. Понятие о санитарно-показательных микроорганизмах
Микроорганизмы, обитающие в кишечнике или в верхнем отделе дыхательных путей человека и животных и постоянно выделяющиеся окружающую среду, называются санитарно — показательными.
По количеству СПМ можно косвенно судить о возможном присутствии патогенов во внешней среде. То есть при их определении исходят из предположения, что чем больше объект загрязнен выделениями человека и животных, тем больше будет СПМ и тем вероятнее присутствие патогенов.
Основные требования, предъявляемые к санитарно-показательным микроорганизмам, следующие:
1) постоянное обитание в естественных полостях организма человека и животных (которые являются их единственной природной средой обитания — биотопом) и выделение их в большом количестве в окружающую среду;
2) продолжительность выживания их в окружающей среде должна быть такой же или большей, чем патогенных микроорганизмов, выводимых из организма теми же путями;
3) не должны размножаться в окружающей среде;
4) не должны сколько-нибудь значительно изменять свои биологические свойства при попадании в окружающую среду;
6) индикация, идентификация и количественный учет должны производиться современными, простыми, легко доступными и экономичными микробиологическими методами.
Все санитарно-показательные микроорганизмы являются индикаторами биологического загрязнения. Выделяют несколько групп микроорганизмов, обнаружение которых в объектах окружающей среды говорит о различных видах загрязнения. Но между группами СПМ нет четких границ, так как некоторые микроорганизмы являются показателями различных видов загрязнения.
Группа А включает обитателей кишечника человека и животных. Они являются индикаторами фекального загрязнения. В нее входят бактерии группы кишечной палочки (БГКП) – эшерихии, цитробактер, энтеробактер, клебсиеллы. Кроме того, в эту группу входят энтерококки, протеи, сальмонеллы, клостридии, термофилы, бактероиды, бактериофаги и др.
Группа В включает обитателей верхних дыхательных путей и носоглотки. Они являются индикаторами орального загрязнения. В нее входят стафилококки (S. aureus), а также зеленящие и гемолитические стрептококки, постоянно обитающие на слизистой оболочке верхних дыхательных путей и выделяющиеся в воздушную среду при разговоре, кашле, чиханье.
Острые кишечные инфекции
ОКИ – большая группа этиологически
полиморфных заболеваний, возбудители
которой принадлежат к различным
группам микроорганизмов(бактерии,
простейшие, вирусы, грибы). Все заболевания
объединены в одну группу на основании
эпидемиологического признака – путь
распространения и входные ворота.
Путь распространения – фекально-оральный,
входные ворота – ЖКТ.
Из простейших возбудителями ОКИ являются
различные виды, но наиболее часто
возбудителями заболеваний являются
лямблии, дизентерийная амеба,
криптоспоридии. Наибольшая роль в
возникновении ОКИ в нашем регионе
принадлежит бактериям:
Iместо сем.Enterobacteriaceae
IIместо сем.Vibrionaceae
IIIместо сем.Campylobacteriaceae
IVместо сем.Bacillaceae
Vместо сем.Clostridiaceae
и др.
Вирусы.Основной причиной
гастроэнтеритов у детей первого года
являются ротавирусы, у детей и взрослых
вызывают ОКИ энтеровирусы, чаще всего
71 типа.
сем. Enterobacteriaceae
Это семейство включает многочисленных
представителей, которые объединены в
одно семейство по следующим признакам:
-
Общность происхождения (родоначальником
является E. coli). -
Генетическое сродство (для всего
семейство молярный % ГЦ ДНК имеет близкие
значения). -
Все энтеробактерии обладают сходными
биологическими свойствами. В процессе
эволюции они дифференцировались на
патогенные, которые в норме не
присутствуют, а попав в организм,
вызывают инфекционный процесс. Вторую
группу составляют условно-патогенные
энтеробактерии, которые входят в состав
нормальной микрофлоры организма
человека, в основном желудочно-кишечного
тракта. -
все энтеробактерии как патогенные,
так и условно-патогенные, могут вызывать
кишечные инфекции, а условно-патогенные
могут вызывать гнойно-воспалительные
и токсико-септические процессы самой
различной локализации, вплоть до
сепсиса.
Биологические свойства
Все энтеробактерии палочкисредней
величины с закругленными концами,
расположенные беспорядочно,аспорогенны,грамотрицательны, капсулообразование
непостоянно. Одни энтеробактерии
подвижны за счет перитрихиально
расположенных жгутиков, другие неподвижны.
По типу получения энергии являютсяфакультативными анаэробами.
Культуральные свойства
Все энтеробактерии нетребовательны к
питательным средам и растут на простых.
На МПА образуют однотипные колонии
средней величины, круглые, гладкие,
выпуклые, бесцветные. На МПБ – равномерное
помутнение.
Биохимические свойства общие для
всего семейства (по этим свойствам
сем.Enterobacteriaceaeотличается от других сходных по
морфологическим свойствам семейств
одной группы по Берджи)
-
Расщепляют глюкозу до кислоты или до
кислоты и газа; -
редуцируют нитраты в нитриты;
-
Каталаза +, оксидаза -, OF-тест
+/+ (окисление и ферментация).
Антигенное строение
Все энтеробактерии имеют О-антиген,
который локализован в клеточной стенке,
К-антиген, который находится либо в
капсуле, либо в субстанции, окружающей
клеточную стенку. Подвижные представители
имеют Н-антиген. Также обнаруживается
аниген фимбрий (пилей, ворсинок) –
Fi-антиген.
Бактериоскопический метод исследования
Клетки микроорганизмов
можно изучать как в живом состоянии
(метод раздавленной капли и метод висячей
капли), так и в фиксированном и окрашенном
состоянии.
Метод раздавленной
капли. На
поверхность обезжиренного предметного
стекла наносят каплю исследуемого
материала или суспензию бактерий и
покрывают ее покровным стеклом. Капля
не должна выходить за края покровного
стекла. Микроскопируют препарат с
объективом х40. Метод раздавленной капли
удобен для исследования подвижности
бактериальных клеток, а также для
изучения крупных микроорганизмов —
плесневых грибов, дрожжей.
Метод висячей
капли.
Препарат готовят на покровном стекле,
в центр которого наносят каплю
бактериальной суспензии. Затем специальное
предметное стекло с лункой, края которой
предварительно смазаны вазелином,
прижимают к покровному стеклу так, чтобы
капля находилась в центре лунки. Препарат
переворачивают покровным стеклом вверх.
В правильно приготовленном препарате
капля должна свободно висеть над лункой,
не касаясь ее дна или краев. Для микроскопии
используют вначале сухой объектив х8,
под увеличением которого находят края
капли, а затем устанавливают объектив
х40 и исследуют препарат.
Приготовление
фиксированных препаратов.
Для приготовления препарата на
обезжиренное предметное стекло наносят
каплю воды или изотонического раствора
хлорида натрия, в которую бактериологической
петлей вносят исследуемый материал и
круговыми движениями петли распределяют
его таким образом, чтобы получить тонкий
и равномерный мазок диаметром 1-1,5 см.
Если исследуют жидкий материал, то его
наносят на предметное стекло непосредственно
петлей и готовят мазок. Мазки высушивают
на воздухе.
Для фиксации
используют физические и химические
методы. Для фиксации мазка физическим
методом предметное стекло медленно
проводят 3 раза через пламя горелки.
Мазки крови, мазки-отпечатки органов и
тканей фиксируют химическим методом
путем погружения их на 5-20 минут в
метиловый или этиловый спирт, смесь
Никифорова и другие фиксирующие жидкости.
Для окрашивания
микробов используют простые и сложные
методы. При простом методе фиксированный
мазок окрашивают каким-либо одним
красителем, например, водным раствором
фуксина (1-2 минуты) или метиленовым синим
(3-5 минут), промывают водой, высушивают
и микроскопируют. Сложные методы
окрашивания включают последовательное
использование нескольких красителей.
Это позволяет выявить определенные
структуры клеток и дифференцировать
одни виды микроорганизмов от других.
Микробиологический анализ мочи
|
10-09-2018, 17:10
|
Анализ мочиПосев мочи и определение чувствительности обнаруженных микробов к антибактериальным препаратам – наиболее востребованные микробиологические исследования в клинических лабораториях. После дыхательной (респираторной) системы, мочевыделительная система больше всего подвержена инфицированию. Микробиологический анализ мочи проводится в бактериологической лаборатории. Эти анализы назначают с целью постановки (или исключения) диагноза инфекционных заболеваний мочевыделительной системы у пациентов без явных симптомов, которые подвержены риску инфицирования мочевыводящих путей.
Какие бактерии выявляют?
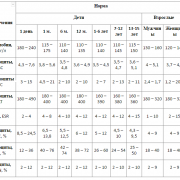
Для каждого вида вод определяют нормативные показатели по содержанию микроорганизмов. Количество варьируется в большую или меньшую степень, но незначительно.
Определяемые патогенные микроорганизмы для микробиологического анализа отличаются для каждого источника.
Данные представлены в таблице:
| Вид источника воды | Разновидность микроорганизмов | Нормы |
| Питьевая | Общее количество микроорганизмов | Не больше 50 КОЭ в 1 мл |
| Колиморфные бактерии | Отсутствуют | |
| Колифаги | Отсутствуют | |
| Сульфатредуцирующие бактерии | Отсутствуют в 20 мл | |
| Поверхностные (открытые) водоемы | Общее число бактерий | Не больше 500 КОЭ в 100 мл |
| Колиморфные бактерии | Не больше 100 КОЭ в 100 мл | |
| Колифаги | Не больше 100 БОЭ в 100 мл | |
| Кишечные инфекции | Отсутствуют | |
| Хозяйственно-бытовые сточные | Общее количество микроорганизмов | 106-108 КОЭ в 100 мл |
| Колифаги | 103-104 БОЭ в 100 мл | |
| Вирусы | Не более 103 БОЭ в 100 мл | |
| Сальмонеллы | 103-106 КОЭ в 100 мл | |
| Туберкулезная палочка | Присутствует | |
| Городские сточные | Общее количество микроорганизмов | 105-107 КОЭ в 100 мл |
| Колифаги | 103-104 БОЭ в 100 мл | |
| Вирусы | Не более 103 БОЭ в 100 мл | |
| Сальмонеллы | 103-104 КОЭ в 100 мл | |
| Туберкулезная палочка | Присутствует | |
| Бассейны | Общее количество микроорганизмов | Не больше 50 КОЭ в 1 мл |
| Колиморфные бактерии | Отсутствуют | |
| Колифаги | Отсутствуют | |
| Сульфатредуцирующие бактерии | Отсутствуют в 20 мл | |
| Туберкулезная палочка | Отсутствуют |
Если степень загрязнения превышает эти данные, источник не пригоден для использования в любой области человеческой деятельности.
Подсчет клеток на фиксированных мазках
Прямое микроскопическое изучение грунта осуществляется по методу микробиологического исследования, разработанному Виноградским. В определенном объеме приготовленной суспензии подсчитывается число клеток микроорганизмов. Изучение фиксированных мазков позволяет сохранять препараты в течение длительного срока и выполнять подсчеты в любое удобное время.
Приготовление препарата осуществляется следующим образом. Определенный объем суспензии (как правило, 0.02-0.05 мл) наносится с помощью микропипетки на предметное стекло. К нему добавляют каплю раствора агар-агара (смеси полисахаридов агаропектина и агарозы, извлеченных из бурых и красных водорослей Черного моря), быстро перемешивают и распределяют на площади 4-6 кв. см. Мазок высушивается на воздухе и фиксируется 20-30 мин. спиртом (96 %). Далее препарат увлажняют дистиллированной водой, помещают в р-р карболового эритрозина на 20-30 мин.
После окрашивания его промывают и высушивают на воздухе. Подсчет клеток осуществляется с иммерсионным объективом.

Что это за исследование и для чего проводится?
 Микробиологический анализ – исследование, определяющее совокупность живых микроскопических организмов, заселяющих образец.
Микробиологический анализ – исследование, определяющее совокупность живых микроскопических организмов, заселяющих образец.
Основная цель – выявление возбудителей заболеваний, поражающих пищеварительный тракт и другие внутренние органы.
Риск обнаружения вредоносных микроорганизмов зависит от глубины, на которой расположен источник воды. Наиболее качественными считаются скважины. В них сосредоточено меньше болезнетворных обитателей.
Для подтверждения качества воды достаточно проведения 2 ежегодных проб. Их делают весной и осенью. Очищение требуется в случае, если пришли плохие результаты.
Последовательность действий и особенности методики
Для проведения бактериологического исследования необходимо выполнить сбор материала и культивировать его на питательных средах с последующей микроскопией полученных штаммов и проверкой чувствительности к антибиотикам.
Сбор материала
Биоматериалом для исследования могут служить кровь, моча, ликвор, мокрота, сперма, кал, мазки из глотки, влагалища, уретры, любые другие ткани и жидкости из области инфекционного процесса. Образцы собирают в асептических условиях, помещают в стерильную посуду и в течение 2-х часов доставляют в лабораторию. При необходимости пробы хранят при пониженных температурах.
Культивирование
Культивирование проводят с применением механических или биологических методов. Механический подход с использованием стандартных искусственных сред – наиболее распространенный. В данном случае для высевания образцов используют жидкие и твердые питательные составы. Наиболее распространенные – агар, мясо-пептонный бульон.
Посев материала производят с помощью специальной петли или пастеровской пипетки, растирая полученный образец по поверхности или вводя его в толщу питательной среды. Выделение бактерий производят из чистых культур, которые получают повторным посевом ранее выращенных колоний на новую среду.
Биологические методы подразумевают использование специальных питательных сред, которые учитывают особенности микроорганизма, в частности, чувствительность к некоторым химическим веществам, в том числе антибиотикам. В некоторых случаях применяют метод заражения лабораторных животных или тканевых культур с отслеживанием патологических изменений. Такой подход актуален при крайне незначительном накоплении микроба в тканях человека – в этом случае его выделение посевом на питательных средах не дает результата.
Микроскопическое исследование
Основной метод бактериологической диагностики – бактериоскопия. Она подразумевает визуальную оценку параметров микроорганизма под микроскопом. Для этого используют фиксированные и нефиксированные препараты.
Нефиксированные препараты позволяют исследовать живые образцы бактерий. Основные методы:
- раздавленная капля – образец придавливают между предметным и покровным стеклами;
- висячая капля – образец помещают в лунку на предметном стекле и герметично накрывают покровным.В качестве среды используют изотонический раствор или расплавленный агар. Методика позволяет наблюдать за живыми микроорганизмами в течение нескольких дней.
Фиксированные препараты используют для окрашивания с подробным изучением морфологических и некоторых биохимических параметров патогенов. Каплю бактериального состава размазывают по предметному стеклу и фиксируют пламенем горелки или специальными химическими составами.
Для определения свойств бактериальных препаратов используют ряд общих и специфических методик:
- микроскопия – определение формы, размеров, окрашивания по Граму;
- биохимические методы – исследование ферментативной способности микроорганизма к расщеплению тех или иных углеводов, аминокислот, метаболитов, в том числе способность к гемолизу, фибринолизу при попадании в кровь живых существ;
- серологические методы идентификации – реакции агглютинации под воздействием специфической сыворотки и другие антигенные свойства;
- биологические методы – заражение лабораторных ждивотных с проверкой патогенности и токсигенности взятых образцов, их устойчивости к антибиотикам.
Только совокупный анализ результатов всех методов диагностики – микроскопических, биохимических, серологических, биологических – дает объективный результат для вынесения точного диагноза.
Воздух
Он считается транзитной средой для микроорганизмов. Основными методами микробиологического исследования воздуха являются седиментация (оседание) и аспирация.
Микрофлора воздушной среды условно разделяется на переменную и постоянную. К первой относятся дрожжи, пигментообразующие кокки, спороносные бациллы, палочки и прочие микроорганизмы, устойчивые к высыханию, воздействию света. Представители переменной микрофлоры, проникая в воздух из привычной для них среды обитания, недолго сохраняют свою жизнеспособность.
В воздухе крупных мегаполисов микроорганизмов намного больше, чем в воздушной среде сельской местности. Над морями, лесами бактерий очень мало. Очищению воздуха способствуют осадки: снег и дождь. В закрытых помещениях микробов намного больше, чем на открытых пространствах. Их количество повышается в зимний период при отсутствии регулярного проветривания.