Бактериологический метод диагностики инфекционных заболеваний его возможности
Содержание:
- Применяемое оборудование
- Бактерии, имеющие медицинское значение
- Кишечная палочка, общая характеристика. Биологическая роль кишечной палочки. Заболевания, вызываемые эшерихиями.
- Взятие гинекологического мазка
- Основные задачи анализа
- 6.10.1. Санитарно-показательные микроорганизмы
- Расшифровка бакпосева
- Необходимые для исследования материалы
- Цель проведения бактериологического посева
- Для чего необходимо бактериологическое исследование?
- Бактериоскопический метод исследования
- Получение изолированных колоний
- 1)Бактериоскопический метод исследования в гинекологии:
- Последовательность действий и особенности методики
- Современные культуральные методы бактериологических исследований
- Преимущества метода
Применяемое оборудование
 При исследовании используется такое оборудования:
При исследовании используется такое оборудования:
- банки с широким горлышком;
- стеклянные воронки;
- конусовидные колбы;
- колбы вместе с тубусом;
- стеклянные флаконы;
- лабораторная посуда;
- пипетки;
- цилиндры;
- бактериологические пробирки;
- спиртовки;
- лабораторные стаканы;
- покровные и предметные стекла;
- бактериологические чаши;
- пробирные поплавки;
- электрический автоклав;
- фильтровальные аппараты;
- кристаллизаторы;
- вакуумный насос;
- лабораторные весы.
Для анализа также используется водоструйный насос. Применяется его лабораторный вариант, выполненный из стекла. Используется водяная баня. Обязательным элементом является биологический микроскоп.
Применяются также:
- осветители;
- металлические пеналы;
- сигнальные часы;
- сетчатые пластины;
- увеличительные лупы;
- pH-метры (для измерения кислотности);
- дистилляторы.
Дополнительно используются:
- электрические термостаты, они предназначены для выращивания микроорганизмов при определенной температуре.
- счетный прибор для измерения выращенных колоний бактерий и сушильные шкафы.
Обязательным элементом являются холодильники. Используются как электрические, так и газовые с температурным режимом от 4С до 6С. Могут применяться походные сумки-холодильники, если бактериологический анализ проводится в полевых условиях.
Бактерии, имеющие медицинское значение
|
Название |
Заболевания |
|
ГРАМПОЛОЖИТЕЛЬНЫЕ |
||
|
Стафилококки |
Staphylococcus |
Гнойно-воспалительные |
|
Стрептококки |
Streptococcus |
То |
|
Энтерококки |
Enterococcus |
To |
|
Микрококки |
Micrococcus |
|
|
Пептококки |
Peptococcus |
|
|
Пептострептококки |
Peptostreptococcus |
|
|
ГРАМОТРИЦАТЕЛЬНЫЕ |
||
|
Гонококки |
Neisseria |
Гонорея |
|
Менингококки |
Neisseria |
Менингококковая |
|
Моракселлы |
Подроды |
Гнойно-воспалительные |
|
Вейлонеллы |
Veillonella |
То |
|
ГРАМОТРИЦАТЕЛЬНЫЕ |
||
|
Escherichia, |
Гнойно-воспалительные |
|
|
Сальмонеллы |
Salmonella
Salmonella
A,
Salmonella |
Брюшной
Паратифы |
|
Шигеллы |
Shigella |
Дизентерия |
|
Иерсинии |
Yersinia
Yersinia
Yersinia |
Чума
Кишечный Псевдотуберкулез |
|
Вибрионы |
Vibrio
Vibrio |
Холера
Пищевая |
|
Пастереллы |
Pasteurella |
Гнойно-воспалительные |
|
Актинобациллы |
Actinobacillus |
То |
|
Гемофилы |
Haemophilus |
Мягкий |
|
Калимматобактерии |
Calymmatobacterium |
Донованоз |
|
Эйкенеллы |
Eikenella |
Гнойно-воспалительные |
|
ГРАМОТРИЦАТЕЛЬНЫЕ |
||
|
Бордетеллы |
Bordetella |
Коклюш |
|
Бруцеллы |
Brucella |
Бруцеллез |
|
Бартонеллы |
Bartonella
Bartonella |
Траншейная |
|
Франциселлы |
Francisella |
Туляремия |
|
Легионеллы |
Legionella |
Легионеллез |
|
Кингеллы |
Kingella |
Гнойно-воспалительные |
|
Ацинетобактеры |
Acinetobacter |
То |
|
Псевдомонады |
Pseudomonas |
— |
|
Стенотрофомона- ды Буркхольдерии |
Stenotrophomonas maltophilia
Burkhoideria
Burkholderia |
— Мелиоидоз Сап |
|
ГРАМОТРИЦАТЕЛЬНЫЕ |
||
|
Бактероиды |
Bacteroides |
Гнойно-воспалительные |
|
Фузобактерии |
Fusobacterium |
То |
|
Лептотрихии |
Leptotrichia |
-« |
|
Prevotella |
-« |
|
|
Порфиромонады |
Porphyromonas |
— |
|
Билофилы |
Bilophila |
-« |
|
ГРАМПОЛОЖИТЕЛЬНЫЕ |
||
|
Бациллы |
Bacillus |
Сибирская
Пищевая |
|
Клостридии |
Clostridium
С.
С.
С.
С.
Clostridium
Clostridium |
Столбняк
Газовая
То Ботулизм
Псевдомембранозный |
|
ГРАМПОЛОЖИТЕЛЬНЫЕ |
||
|
Лактобациллы |
Lactobacillus |
Представитель |
|
Листерии |
Listeria |
Листериоз |
|
ГРАМПОЛОЖИТЕЛЬНЫЕ
И |
||
|
Коринебактерии |
Corynebacterium |
Дифтерия |
|
Микобактерии |
(
M.
M.
Условно-патогенные |
Туберкулез Микобактериоз
Проказа |
|
Актиномицеты |
Actinomyces |
Гнойно-воспалительные |
|
Нокардии |
Nocardia |
То |
|
Бифидобактерии |
Bifidobacterium |
Представитель |
|
Эубактерии |
Eubacterium |
Гнойно-воспалительные |
|
Пропионибактерии |
Propionibacterium |
То |
|
Мобилункусы |
Mobiluncus |
— |
Кишечная палочка, общая характеристика. Биологическая роль кишечной палочки. Заболевания, вызываемые эшерихиями.
1. Классификация:
домен — Bacteria,
тип — Proteobacteria,
класс — Gammaproteobacterias,
порядок Enterobacteriales,
семейство Enterobacteriaceae,
род — Escherichia,
вид — E.coli
2. Морфология:
Гр-, палочка, иногда капсула или
микрокапсула, иногда есть перитрихии,
подвижна или неподвижна, спор нет.
3. Тип
питания: хемоорганотроф.
4. Биологические
свойства:
а) хорошо растут на простых питательных
средах
б) ферментируют глюкозу и
лактозу до кислоты и газа
5. АГ
структура: О-антиген,
К-антиген и Н-антиген.
6. Факторы
патогенности и патогенез:
а) адгезины (капсула – также угнетает
фагоцитоз, пили)
б) третья секреторная система
в) ферменты инвазии
г) эндотоксин (ЛПС)
д) энтеротоксин — активирует
аденилатциклазу, приводит к водянистой
диарее.
е) экзотоксины (шигоподобный, холероподобный)
ж)нуклеопротеиды – вызывают
повышенную чувствительность к МБ.
Адгезия на энтероцитах
активный захват энтероцитами и их
колонизация, фагоцитоз пейеровыми
бляшками и разрушение лимфоцитов
изменению функции энтероцитов, продукция
гемолизинов, энтеротоксинов
увеличение кол-ва цАМФ (водянистая
диарея), иногда развитие колитов.
7. Клинические
проявления:
а) эндогенные инфекции –
гнойно-воспалительные процессов
различных локализации (пиелиты, циститы,
холециститы).
б) ОКИ: ЭПКП – сальмонеллоподобные
инфекции, ЭТКП – холероподобные инфекции,
ЭИКП – дизентериеподобные инфекции,
ЭГКП – геморрагический колит.
8. Иммунитет:
ГИО (АТ не обладает протективным
действием).
9. Эпидемиология.
Источник – больные люди или бактерионосители.
ОПЗ – алиментарный. Используется как
санитарный показатель для оценки
загрязнений (коли-титр, коли-индекс).
Устойчивы во внешней среде, месяцами
сохраняются в почве, воде, испражнениях.
10. Профилактика:
специфической нет. Неспецифическая:
выявление больных и носителей, их
изоляция, лечение.
11. Лечение:
бифидобактерин, лактобактерин – для
детей раннего возраста, АБ (хлорамфеникол,
цефалоспорины, фторхинолон).
12. Диагностика:
Цель:
выделение чистой культуры и отличие ее
от УПН. Материал для
исследования: фекальные
массы.
Бактериологический метод:
1-й этап — посев на среду Эндо (Левина);
2-й этап:
а) обнаружение окрашенных колоний,
микроскопия их по Граму;
б) РА на стекле со смесью
сывороток к патогенным серогруппам
(предварительная дифференциация
патогенных эшерихии от условнопатогенных)
в) отсев положительно
реагирующей в РА колонии на среду
Олькеницкого;
3-й этап:
а) учет изменения среды Олькеницкого
(посинение и разрыв всей среды);
б) определение чистоты выделенной
культуры;
в) определение серовара
патогенной эшерихии (путем постановки
РА с отдельными ОК-сыворотками на стекле
и в пробирках с живой (определение
К-антигена) и убитой кипячением
(определение О-антигена) культурой;
г) проба на индол, подвижность и
чувствительность к антибиотикам.
Серологический метод— постановка
РА с сывороткой больного (на 2-ой неделе
заболевания).
Взятие гинекологического мазка
Гинекологический мазок берут для оценки состояния половых путей женщины. Анализ клеток из влагалища и цервикального канала помогает выявить хронические воспаления, половые инфекции, обнаружить развитие женской онкологии на ранних стадиях.
В профилактических целях мазки берут ежегодно у всех женщин репродуктивного возраста. Внеочередной забор материала может понадобиться при:
- подготовке к беременности или процедуре ЭКО;
- появлении тревожных симптомов – зуд, жжение, высыпания, бородавки в интимной зоне, нарушение менструального цикла;
- после полового контакта с новым партнером (без барьерной контрацепции);
- при частых абортах и неоднократных выкидышах;
- после длительной терапии гормонами или антибиотиками.
Нерегулярный цикл
Случайные связи
Терапия гормонами
Женщинам с отягощенной наследственностью мазок из шейки матки и влагалища рекомендуют сдавать 2 раза в год. Взятие мазка из половых путей женщин проводит гинеколог во время осмотра пациентки на кресле. Врач собирает биоматериал из влагалища, наружного зева матки и канала шейки матки.
Гинекологический мазок на флору
Материал помогает оценить степень микробной чистоты влагалища. Взятие мазков на флору – безболезненная процедура. Однако результаты этого анализа дают врачу важную информацию о состоянии естественной микрофлоры и заражении патогенными микроорганизмами.
Исследование позволяет диагностировать такие патологии:
- вагинит;
- гонорея;
- кандидоз;
- трихомониаз;
- цервицит и другие болезни, вызванные патогенной флорой.
Для анализа состава микрофлоры применяют метод микроскопии с окрашиванием по Граму. Методика основана на способности бактериальной клетки по-разному реагировать на контакт с анилиновыми красителями:
- Грамположительные бактерии – окрашиваются в синий (фиолетовый) цвет. Эти микроорганизмы отличаются простым строением, а их клеточная оболочка очень чувствительная к воздействию антибактериальных препаратов.
- Грамотрицательные бактерии – при воздействии красителя обесцвечиваются. Их клеточная стенка имеет сложное строение. Это позволяет им сохранять устойчивость к большинству антибиотиков. Именно грамотрицательные бактерии чаще всего вызывают патологии женской половой системы.
После окрашивания по Граму и исследования материала под микроскопом, используют метод бактериологического посева клеток на питательную среду. Оказавшись в благоприятных условиях микроорганизмы начинают активно расти, образуя колонии. Эти колонии идентифицируют, после чего испытывают на чувствительность к антибиотикам
Это важно для назначения эффективного лечения
Взятие мазка на чистоту влагалища точно определяет возбудителя болезни и оценивает его чувствительность к антибактериальным препаратам разных групп.
Мазок на скрытые инфекции
Ряд заболеваний половой системы протекают без симптомов и могут никак не проявлять себя на протяжении многих лет. При этом они нарушают половую и репродуктивную функцию, вызывают бесплодие, нарушают развитие плода во время беременности.
К скрытым инфекциям относят:
- гонорею;
- сифилис;
- генитальный герпес;
- вирус папилломы человека;
- уреаплазмоз;
- хламидиоз.
После взятия мазка на скрытые инфекции, материал направляют в лабораторию для проведения ПЦР-диагностики. Техника позволяет точно определить специфические ДНК молекулы патогенных микроорганизмов. Методика очень точная и чувствительная. Даже одна микробная клетка в образце может быть выявлена во время анализа.
Взятие мазка на онкоцитологию
Это анализ клеточной структуры тканей половых органов. Взятие мазка из цервикального канала проводят при подозрении на дисплазию эпителия и онкологию. Это наиболее эффективный способ ранней диагностики злокачественных опухолей. Забор мазка из цервикального канала также информативен при хроническом воспалении и половых инфекциях.
В лаборатории мазок на онкоцитологию окрашивают и исследуют под мощным микроскопом для выявления аномалий и дефектов строения клеток. По результатам взятия мазков на цитологическое исследование пациентка получает один из пяти типов цитограмм:
- 1 класс – атипичные клетки отсутствуют (норма);
- 2 класс – выявлены воспалительные изменения структуры клеток;
- 3 класс – имеются выраженные признаки дисплазии ткани;
- 4 класс – подозрения на рак и эрозию шейки матки;
- 5 класс – онкологический процесс.
Основные задачи анализа
Здесь перечислены по пунктам цели и этапы бактериологического метода исследования.
1. Получить исходный материал, который будет использоваться для выделения колоний бактерий. Это может быть мазок с поверхности любого предмета, слизистой оболочки или полости органа человека, анализ крови.
2. Выращивание культуры на твердой питательной среде. Через 24-48 часов на чашке Петри можно обнаружить колонии бактерий разных видов. Отбираем по морфологическим и/или биохимическим критериям нужную и проводим уже с ней дальнейшую работу.
3. Размножение полученной культуры. Бактериологический метод исследования может опираться на механический или биологический способ увеличения численности культуры бактерии. В первом случае ведется работа с твердыми или жидкими питательными средами, на которых в термостате размножаются бактерии и образуют новые колонии. Биологический способ требует естественных условий увеличения численности бактерий, поэтому здесь микроорганизмами заражается подопытное животное. Через несколько суток в пробе крови или мазке можно обнаружить множество прокариот.
4. Работа с очищенной культурой. Чтобы определить систематическое положение бактерий, а также их принадлежность к возбудителям заболеваний, необходимо провести тщательный анализ клеток по морфологическим и биохимическим признакам
При исследовании патогенных групп микроорганизмов важно знать, насколько эффективно действие антибиотиков
Это была общая характеристика бактериологического метода исследования.
6.10.1. Санитарно-показательные микроорганизмы
Санитарно-показательные
микроорганизмы (СПМ)
– это представители нормальной
микрофлоры, которые выделяются
естественным путем в окружающую среду
и там сохраняются, поэтому служат
показателями санитарного неблагополучия,
потенциальной опасности исследуемых
объектов. Так, если на объектах обнаруживают
нормальных обитателей кишечника, делают
заключение о наличии фекального
загрязнения и возможном присутствии
патогенных энтеробактерий. Так как
патогенных представителей меньше и
выделить их труднее, то вначале выявляют
санитарно-показательные микроорганизмы
в окружающей среде, а после их выявления
можно проводить поиск патогенных.
СПМ условно
разделяют на 3 группы:
1.Группа
А включает
обитателей кишечника человека и животных,
эти микроорганизмы расценивают как
индикаторы фекального загрязнения. В
нее входят бактерии группы кишечной
палочки (БГКП) – эшерихии, энтерококки,
протеи, сульфитвосстанавливающие
клостридии (С.
perfringens),
термофилы, бактериофаги, ацинетобактер,
аэромонады.
2.Группа
В включает
обитателей верхних дыхательных путей
и носоглотки. В нее входят a-
и b-гемолитические
стрептококки, стафилококки
(плазмокоагулирующие, лецитиназоположительные,
гемолитические и антибиотикоустойчивые).
3.Группа
С включает
сапрофитические микроорганизмы,
обитающие во внешней среде, их расценивают
как индикаторы процессов самоочищения.
В нее входят бактерии-аммонификаторы,
бактерии-нитрификаторы, некоторые
спорообразующие бактерии, грибы,
актиномицеты, целлюлозобактерии,
сине-зеленые водоросли.
Санитарно-показательные
микробы должны отвечать следующим
требованиям:
они должны постоянно содержаться в
выделениях человека и теплокровных
животных и поступать в окружающую среду
в больших количествах; не должны иметь
другого природного резервуара, кроме
организма человека и животных; после
выделения их в окружающую среду, должны
сохранять жизнеспособность в течение
сроков, близких к срокам выживания
патогенных микробов, выводимых из
организма теми же путями; СПМ не должны
размножаться в окружающей среде; не
должны изменять свои биологические
свойства в окружающей среде; должны
быть типичными, чтобы их диагностика,
индикация и идентификация осуществлялась
без особого труда.
Санитарно-показательные
бактерии окружающей среды.
1.Вода
– бактерии группы кишечной палочки
(БГКП), энтерококки, стафилококки.
2.Почва
– БГКП, энтерококки, термофилы, возбудители
газовой гангрены.
3.Воздух
– бета-гемолитические стрептококки,
стафилококки.
4.Пищевые
продукты – БГКП, энтерококки, стафилококки,
протей.
5.Предметы
обихода – БГКП, фекальные стрептококки,
стафилококки.
Расшифровка бакпосева
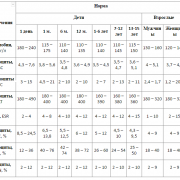
Результат анализа оценивается по нескольким показателям, учитывающим не только качественный фактор (подтверждение наличия бактерий-возбудителей в среде), но и количественный — то есть, степень концентрации патогенных микроорганизмов в исследуемом материале. Для подсчета количества микробных клеток используется понятие колониеобразующей единицы (КОЕ), по которому можно определить уровень насыщенности бактериями изучаемого образца.
Выделяют 4 степени роста возбудителей:
- Первая — скудный рост бактерий на жидкой питательной среде и отсутствие роста на твердой среде. Такой результат не считается отклонением от нормы.
- Вторая — рост бактерий на твердой среде до 10 колоний. Свидетельствует не о наличии болезни, а скорее о загрязненности лабораторных принадлежностей для исследования.
- Третья — рост бактерий на твердой среде в пределах 10-100 колоний.
- Четвертая — более 100 колоний.
В заключении, выдаваемом на руки пациенту, результаты бакпосева обозначаются следующим образом:
- указывается название выявленного возбудителя на латинском языке (например, Trichomonas vaginalis — трихомонада);
- прописывается концентрация микроорганизма, выращенного в условиях питательной среды (норма — до 103 КОЕ/мл, ненорма — от 105 КОЕ/мл);
- указывается характер среды: флора условно-патогенна, патогенная.
Одновременно с определением концентрации бактерий производится анализ их чувствительности к антибиотикам. Наличие положительной реакции на тот или иной антибактериальный препарат обозначается символом «S», отрицательной — «R».
Необходимые для исследования материалы
Для изучения анализов по бактериоскопическому методу необходимы следующие инструменты:
- Металлическая петля.
- Предметное стекло. Этот предмет обязательно должен быть чист, так как любое его загрязнение может повлиять на состояние образца.
- Пинцет.
- Фильтровальная бумага.
Очистка новых предметных стекол производится с помощью 1%-ного раствора соды. После кипячения в таком растворе стекло промывается дистиллированной водой, слабым раствором соляной кислоты, а затем снова дистиллированной водой. Бывшие в употреблении стекла очищаются в несколько этапов: сначала их помещают в раствор серной кислоты на 60-120 минут, затем кипятят в растворе соды, после чего производится промывка стекла водой. После этого стекло опускают в медицинский спирт.
Хранить приборные стекла нужно либо в спирте, либо в плотно закрытых емкостях. Причем в последнем случае стекла должны быть сухими.
Для данного исследования также понадобятся следующие химические реактивы:
- Спирт;
- Раствор Люголя;
- Красители.
Наиболее часто используемыми красителями являются фуксин Циля, метиленовый синий и карболовый генцианвиолет. Последний краситель представляет из себя раствор обычного фуксина в пятипроцентной карболовой воде
Цель проведения бактериологического посева
Метод бакпосева достаточно распространен в медицинской практике, применяясь для диагностики заболеваний в самых разных областях медицины: хирургии, онкологии, гастроэнтерологии, отоларингологии и т. д. В гинекологии и урологии данный вид лабораторного анализа используется для исследования микрофлоры в целях диагностики следующих возбудителей:
- микоплазмоза и уреаплазмоза;
- трихомониаза;
- кандидоза (молочницы);
- хламидиоза.
По итогам исследования можно не только выявить наличие патогенных бактерий, но и определить их количественных состав. Что, в свою очередь, дает понимание того, на какой стадии прогрессирует болезнь, и скоординировать дальнейшее лечение.
Помимо мазка из половых органов для бакпосева используется также и ряд других разновидностей биологического материала. Например:
- Кровь — для проверки на стерильность, при внутрисосудистых инфекциях, эндокардите.
- Слизистая из носа, горла — для выявления вирусов и бактерий, провоцирующих риниты, синуситы, ангины и другие ЛОР-заболевания.
- Кал — для диагностирования дисбактериоза и прочих нарушений желудочно-кишечного тракта.
- Желчь — при наличии воспалительных заболеваний печени, поджелудочной железы, желчного пузыря.
- Мокроты — для определения инфекций дыхательных путей, в частности, туберкулеза легких.
- Слизистая глаз — при развитии гнойных воспалений глаз и других офтальмологических патологий.
- Кожный жир — для выявления стафилококков, грибков и прочих представителей патогенной флоры, скапливающихся в эпителиальном слое кожи лица.
Для чего необходимо бактериологическое исследование?
Бактериологические исследования позволяют идентифицировать возбудителя болезни и установить его степень чувствительности к определенным антибиотикам для выявления эффективности лечения. Данный метод исследования широко применяется в медицинской практике инфекционистами, отоларингологами, гинекологами, урологами, онкологами, хирургами и другими специалистами. Он назначается при любых воспалительных заболеваниях в организме и при подозрении на развитие сепсиса.
Как правильно осуществить забор материала?
Материалом для бактериологических исследований может служить кровь, ликвор, мокрота, испражнения, моча, желчь, спинномозговая жидкость, грудное молоко, выделения из ротовой полости, половых органов, зева, носоглотки и ран.
Главное требование забора – стерильность посуды и инструментов. При несоблюдении этого требования результаты окажутся совершенно неправильными, так как произойдет обсеменение собранного материала.
Брать биологический материал для исследований следует до начала приема антибиотиков. В противном случае результат существенно исказится.
Полученный материал необходимо немедленно доставить в лабораторию, чтобы не допустить его гибели.
В нашей лаборатории забор биологических жидкостей выполняется в абсолютно стерильных условиях специально обученными медсестрами в соответствии со всеми правилами, что гарантирует качество собранного материала и достоверность полученных результатов.
Как проходит исследование?
Бактериологические исследования включают несколько этапов, на проведение которых требуется от 3 до 10 дней.
Чтобы выделить чистую культуру возбудителя, осуществляют посев полученного материала на специальную питательную среду, на которой способен жить только определенный вид микроорганизмов. Например, для идентификации дифтерийной палочки применяют теллуритовую среду, а для обнаружения кишечной палочки – среду Эндо. Если требуется выделить условно-патогенные микроорганизмы, то пользуются универсальными питательными средами, чаще всего кровяным агаром.
Питательную среду помещают в термостат, чтобы создать оптимальные условия для роста и размножения микроорганизмов.
По истечении определенного времени производят контрольный осмотр полученных колоний
Если необходимо, используют специальные красители, позволяющие обнаружить определенные штаммы бактерий.
При контрольном осмотре обращают внимание на цвет, форму и плотность колонии, ее способность к разложению некоторых органических и неорганических соединений. Затем с помощью специальных методов подсчитывают количество микроорганизмов в образце.
Плюсы и минусы бактериологического исследования
Бактериологический посев имеет несколько преимуществ:
- характеризуется высокой специфичностью;
- позволяет проводить исследование любой биологической жидкости;
- дает возможность определить чувствительность патогенного микроорганизма к определенному лекарству и правильно подобрать терапию.
Но есть у этого метода и некоторые недостатки:
- результат можно получить только по происшествии нескольких дней;
- требует высокой квалификации персонала бактериологической лаборатории;
- предъявляет высокие требования к забору материала.
Результат исследования
Результатом бактериологического исследования является обнаружение возбудителя (или его отсутствие) в собранном материале и выявление его концентрации, что позволяет подобрать результативную терапию и эффективно избавиться от возбудителей.
Бактериоскопический метод исследования
Клетки микроорганизмов
можно изучать как в живом состоянии
(метод раздавленной капли и метод висячей
капли), так и в фиксированном и окрашенном
состоянии.
Метод раздавленной
капли. На
поверхность обезжиренного предметного
стекла наносят каплю исследуемого
материала или суспензию бактерий и
покрывают ее покровным стеклом. Капля
не должна выходить за края покровного
стекла. Микроскопируют препарат с
объективом х40. Метод раздавленной капли
удобен для исследования подвижности
бактериальных клеток, а также для
изучения крупных микроорганизмов —
плесневых грибов, дрожжей.
Метод висячей
капли.
Препарат готовят на покровном стекле,
в центр которого наносят каплю
бактериальной суспензии. Затем специальное
предметное стекло с лункой, края которой
предварительно смазаны вазелином,
прижимают к покровному стеклу так, чтобы
капля находилась в центре лунки. Препарат
переворачивают покровным стеклом вверх.
В правильно приготовленном препарате
капля должна свободно висеть над лункой,
не касаясь ее дна или краев. Для микроскопии
используют вначале сухой объектив х8,
под увеличением которого находят края
капли, а затем устанавливают объектив
х40 и исследуют препарат.
Приготовление
фиксированных препаратов.
Для приготовления препарата на
обезжиренное предметное стекло наносят
каплю воды или изотонического раствора
хлорида натрия, в которую бактериологической
петлей вносят исследуемый материал и
круговыми движениями петли распределяют
его таким образом, чтобы получить тонкий
и равномерный мазок диаметром 1-1,5 см.
Если исследуют жидкий материал, то его
наносят на предметное стекло непосредственно
петлей и готовят мазок. Мазки высушивают
на воздухе.
Для фиксации
используют физические и химические
методы. Для фиксации мазка физическим
методом предметное стекло медленно
проводят 3 раза через пламя горелки.
Мазки крови, мазки-отпечатки органов и
тканей фиксируют химическим методом
путем погружения их на 5-20 минут в
метиловый или этиловый спирт, смесь
Никифорова и другие фиксирующие жидкости.
Для окрашивания
микробов используют простые и сложные
методы. При простом методе фиксированный
мазок окрашивают каким-либо одним
красителем, например, водным раствором
фуксина (1-2 минуты) или метиленовым синим
(3-5 минут), промывают водой, высушивают
и микроскопируют. Сложные методы
окрашивания включают последовательное
использование нескольких красителей.
Это позволяет выявить определенные
структуры клеток и дифференцировать
одни виды микроорганизмов от других.
Получение изолированных колоний
1. Метод Дригальского. Он заключается в том, что на бактериальную петлю наносится мазок с различными видами микроорганизмов. Этой петлей проводят по первой чашке Петри с питательной средой. Далее, не меняя петлю, методом остаточного материала проводят по второй и третьей чашкам Петри. Так, на последних образцах колонии бактерии будут засеваться не слишком плотно, тем самым упрощается возможность найти необходимые для работы бактерии.
2. Метод Коха. В нем используются пробирки с расплавленной питательной средой. Туда помещается петля или пипетка с мазком бактерий, после чего содержимое пробирки выливается на специальную пластинку. Агар (или желатин) застывает через какое-то время, а в его толще легко обнаружить нужные колонии клеток
Важно перед началом работы развести смесь бактерий в пробирках, чтобы концентрация микроорганизмов не была очень большой
Этапы которого основаны на выделении нужной культуры бактерий, не обходится без этих двух способов нахождения изолированных колоний.
1)Бактериоскопический метод исследования в гинекологии:
Бактериоскопический
метод – определение
микрофлоры содержимого влагалища и
возможного возбудителя в мазках, взятых
из цервикального канала, влагалища
и уретры. В зависимости от характера
микробной флоры различают четыре степени
чистоты влагалища:
I
степень чистоты
— рН кислая (4,0—4,5);
II
степень чистоты
— рН кислая (5,0—5,5). I и II степени
чистоты считаются нормальными;
III
степень чистоты
— рН слабощелочная (6,0—6,5);
IV
степень чистоты
— рН слабощелочная. III и IV степени
соответствуют патологическим процессам.
2)Для бактериологического
исследования посылается
материал из: цервикального канала,
содержимое (полученное при пункции
брюшной полости через задний свод
влагалища), брюшной полости во время
операции. Исследованию подвергаются
материал, полученный с шейки или полости
матки, из влагалища, а также асцитическая
жидкость, содержимое опухоли и т.д. Цель
этого исследования — определение
возбудителя и чувствительности к
антибиотикам в материале, взятом из
цервикального канала, влагалища, полости
матки, брюшной полости и т.д., при острых
и хронических воспалительных процессах
гениталий.
3)Для цитологического
исследования материал
можно взять с поверхности влагалищной
части шейки матки, цервикального канала,
из полости матки, плевральной и брюшной
полости, с помощью шпателя. Данный
применяется для ранней диагностики
патологических изменений в эпителии.
Последовательность действий и особенности методики
Для проведения бактериологического исследования необходимо выполнить сбор материала и культивировать его на питательных средах с последующей микроскопией полученных штаммов и проверкой чувствительности к антибиотикам.
Сбор материала
Биоматериалом для исследования могут служить кровь, моча, ликвор, мокрота, сперма, кал, мазки из глотки, влагалища, уретры, любые другие ткани и жидкости из области инфекционного процесса. Образцы собирают в асептических условиях, помещают в стерильную посуду и в течение 2-х часов доставляют в лабораторию. При необходимости пробы хранят при пониженных температурах.
Культивирование
Культивирование проводят с применением механических или биологических методов. Механический подход с использованием стандартных искусственных сред – наиболее распространенный. В данном случае для высевания образцов используют жидкие и твердые питательные составы. Наиболее распространенные – агар, мясо-пептонный бульон.
Посев материала производят с помощью специальной петли или пастеровской пипетки, растирая полученный образец по поверхности или вводя его в толщу питательной среды. Выделение бактерий производят из чистых культур, которые получают повторным посевом ранее выращенных колоний на новую среду.
Биологические методы подразумевают использование специальных питательных сред, которые учитывают особенности микроорганизма, в частности, чувствительность к некоторым химическим веществам, в том числе антибиотикам. В некоторых случаях применяют метод заражения лабораторных животных или тканевых культур с отслеживанием патологических изменений. Такой подход актуален при крайне незначительном накоплении микроба в тканях человека – в этом случае его выделение посевом на питательных средах не дает результата.
Микроскопическое исследование
Основной метод бактериологической диагностики – бактериоскопия. Она подразумевает визуальную оценку параметров микроорганизма под микроскопом. Для этого используют фиксированные и нефиксированные препараты.
Нефиксированные препараты позволяют исследовать живые образцы бактерий. Основные методы:
- раздавленная капля – образец придавливают между предметным и покровным стеклами;
- висячая капля – образец помещают в лунку на предметном стекле и герметично накрывают покровным.В качестве среды используют изотонический раствор или расплавленный агар. Методика позволяет наблюдать за живыми микроорганизмами в течение нескольких дней.
Фиксированные препараты используют для окрашивания с подробным изучением морфологических и некоторых биохимических параметров патогенов. Каплю бактериального состава размазывают по предметному стеклу и фиксируют пламенем горелки или специальными химическими составами.
Для определения свойств бактериальных препаратов используют ряд общих и специфических методик:
- микроскопия – определение формы, размеров, окрашивания по Граму;
- биохимические методы – исследование ферментативной способности микроорганизма к расщеплению тех или иных углеводов, аминокислот, метаболитов, в том числе способность к гемолизу, фибринолизу при попадании в кровь живых существ;
- серологические методы идентификации – реакции агглютинации под воздействием специфической сыворотки и другие антигенные свойства;
- биологические методы – заражение лабораторных ждивотных с проверкой патогенности и токсигенности взятых образцов, их устойчивости к антибиотикам.
Только совокупный анализ результатов всех методов диагностики – микроскопических, биохимических, серологических, биологических – дает объективный результат для вынесения точного диагноза.
Современные культуральные методы бактериологических исследований
Определение 6
Питательная среда – это однокомпонентный или многокомпонентный субстрат, применяемый для культивирования микроорганизмов или культур клеток высших организмов.
Нужно понимать, что современные культуральные методы дают возможность не просто обнаружить микроб и определить количество бактерий, которые присутствуют во взятом биологическом материале.
Выявляя рост бактерий, можно понять к каким антибиотикам или антибактериальным средствам они имеют чувствительность. При этом в питательную среду добавляют многие современные препарат и оценивают, каким образом они влияют на процесс размножения бактерий. Если рост бактерии прекращается, то бактерия чувствительна к препарату, если же рост бактерии продолжается, то бактерия имеет определенную степень устойчивости. В любом случае необходимо проводить несколько исследований в динамике.
Таким образом, эволюция бактериологических исследований шла по пути усложнения и уточнения способов диагностики. При этом микроскопия, как простой метод бактериологического исследования сохраняет собственные позиции и часто используется при необходимости обнаружения бактерий с характерными морфологическими характеристиками.
Преимущества метода
Основными плюсами бактериологического посева можно назвать следующие:
- Высокая точность исследований. В отличие от ИФА (иммуноферментный анализ), ПЦР (полимеразная цепная реакция), вероятность получения ложноотрицательных и ложноположительных результатов практически равна нулю.
- В качестве биологического материала возможно использование абсолютно любой жидкости, выделяемой из организма человека.
- Разработка атибиотикограммы. То есть, установление степени воздействия на выявленные микробы того или иного антибиотика, что позволяет проводить лечебные назначения с максимально высокой точностью.